
| HCN |
| HCl |
| H2O |
| 浓H2SO4 |
| △ |
| ①O3 |
| Zn/H2O |


| 12 |
| 0.1 |
| 7.2g |
| 18g/mol |
| 0.8mol |
| 0.1mol |
| 0.4mol×2 |
| 0.1mol |
| 120-12×8-8 |
| 16 |
 ,D为
,D为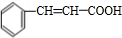 ,C为
,C为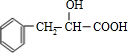 ,B为
,B为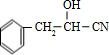 ,A的结构简式为
,A的结构简式为 ,据此解答.
,据此解答.| 12 |
| 0.1 |
| 7.2g |
| 18g/mol |
| 0.8mol |
| 0.1mol |
| 0.4mol×2 |
| 0.1mol |
| 120-12×8-8 |
| 16 |
 ,D为
,D为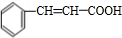 ,C为
,C为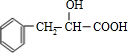 ,B为
,B为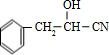 ,A的结构简式为
,A的结构简式为 ,
, ,B为
,B为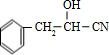 ,苯环上C原子成3个σ键,没有孤电子对,采取sp2杂化,侧链中亚甲基、次甲基中C原子成4个σ键,没有孤电子对,采取sp3杂化,-CN中C原子成2个σ键,没有孤电子对,采取sp杂化,
,苯环上C原子成3个σ键,没有孤电子对,采取sp2杂化,侧链中亚甲基、次甲基中C原子成4个σ键,没有孤电子对,采取sp3杂化,-CN中C原子成2个σ键,没有孤电子对,采取sp杂化, ;sp、sp2、sp3;
;sp、sp2、sp3; ,该反应类型是酯化反应,
,该反应类型是酯化反应, ;酯化反应;
;酯化反应;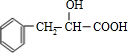 )的同分异构体有多种,其中符合下列要求的有机物有多种:
)的同分异构体有多种,其中符合下列要求的有机物有多种: ,
, ;
;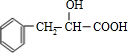 )与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,可以是C中的羧基与4-甲基-2,3-戊二醇中的两个羟基分别反应得两种物质,也可以是C中的羟基与4-甲基-2,3-戊二醇中的羟基成醚的反应也可以得两种结构,也可以是C中的羧基和羟基同时与4-甲基-2,3-戊二醇中的两个羟反应,也可以得两种结构,所以共有6种生成物,
)与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,可以是C中的羧基与4-甲基-2,3-戊二醇中的两个羟基分别反应得两种物质,也可以是C中的羟基与4-甲基-2,3-戊二醇中的羟基成醚的反应也可以得两种结构,也可以是C中的羧基和羟基同时与4-甲基-2,3-戊二醇中的两个羟反应,也可以得两种结构,所以共有6种生成物,

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| A、对于N2(g)+3H2(g)?2NH3(g),缩小体积使压强增大 |
| B、对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入Ar |
| C、对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入N2 |
| D、对于N2(g)+3H2(g)?2NH3(g),容器气体压强不变时,充入Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的物质的量浓度不再改变 |
| B、nN2:nH2:nNH3=1:3:2 |
| C、N2和H2物质的量之和为NH3的2倍 |
| D、单位时间内反应1mol N2同时反应3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
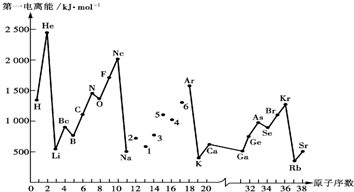
| A、气态电中性基态原子失去电子转化为气态基态正离子所需要的最低能量叫做第一电离能 |
| B、因为乙烯当中含有σ键,所以容易发生加成反应 |
| C、电负性的大小也可以作为判断金属性和非金属性强弱的尺度 |
| D、同主族元素从上到下第一电离能逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学活动课上,某同学分别用图示A、B两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”.在相同条件下,将两个胶头滴管中的盐酸同时滴加到试管中,观察长直玻璃管内液面高低的变化.请回答下列问题:
化学活动课上,某同学分别用图示A、B两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”.在相同条件下,将两个胶头滴管中的盐酸同时滴加到试管中,观察长直玻璃管内液面高低的变化.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、断开1 mol H-H键所吸收的能量和形成1 mol H-H键的所放出的能量相同 |
| B、化学反应吸收或放出热量的多少与参加反应的物质的物质的量有关 |
| C、物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 |
| D、在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com