
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠和碳酸氢钠均与Ca(OH)2反应产生沉淀;
B.乙醇和I2和CCl4互溶;
C.缺少干燥装置;
D.利用中和滴定,可测定NaOH溶液的浓度.
解答 解:A.碳酸钠和碳酸氢钠均与Ca(OH)2反应产生沉淀,故Ca(OH)2溶液比较是否有沉淀生成的方法不能鉴别二者,故A错误;
B.乙醇和I2和CCl4互溶,不分层,无法分离,故B错误;
C.缺少干燥装置,缺少干燥管,故C错误;
D.利用中和滴定原理,可以用盐酸测定氢氧化钠溶液的浓度,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质检验、气体的制备及中和滴定实验等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
 +2C2H5OH
+2C2H5OH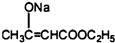 +CH3COOH→
+CH3COOH→ +CH3COONa
+CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )| A. | 能溶于水 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生酯化反应 | D. | 遇FeCl3溶液呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题:
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题: HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.
HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 2-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H-OH$\frac{\underline{催化剂}}{△}$CH3-CH2-OH | |
| B. | CH2=CH-CH=CH2+2H2$\frac{\underline{\;催化剂\;}}{\;}$CH3-CH2-CH2-CH3 | |
| C. |  +H2$\stackrel{催化剂}{→}$CH3-CH2-OH +H2$\stackrel{催化剂}{→}$CH3-CH2-OH | |
| D. | CH3-CH3+2Cl2$\stackrel{光照}{→}$CH2Cl-CH2Cl+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com