
科目:高中化学 来源:2016届山东省临沂市高三上学期第一次月考化学试卷(解析版) 题型:填空题
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在____________.
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.


(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
①所有的离子方程式 均可以表示一类反应 | |
②酸碱中和反应均 可表示为:H++OH―===H2O | |
③离子方程式中凡 是难溶性酸、碱、盐均要用“↓” |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42―=BaSO4↓”来表示,请写出有关反应的化学方程式(三个):
①_________________________________;
②_________________________________;
③_________________________________.
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期期中测试理综化学试卷(解析版) 题型:填空题
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强.常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3 反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)写出A溶于水生成弱酸B的化学方程式 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论错误的是
选 项 | 实验操作 | 实验现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有完全变质 |
B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红,下层溶液呈紫红色 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al的 |
D | 取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 | 溶液变为红色 | 绿矾部分或全部被氧化 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上期中测试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.从1L1mol/L的氯化钠溶液中取出10ml后,其浓度仍是1mol/L
B.NaHSO4溶液与NaOH溶液反应的离子方程式:H+ +OH-= H2O
C.FeCl3溶液呈电中性,Fe(OH)3胶体带正电
D.氧化剂具有氧化性,是得到电子(或电子对偏向)的物质,反应时本身被还原
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期半期考试化学试卷(解析版) 题型:填空题
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题:
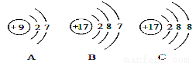
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省清远市高二上学期10月月考化学试卷(解析版) 题型:选择题
一定能使反应速率加快的因素是:①扩大容器的容积;②使用催化剂;③增加反应物的质量;④升高温度;⑤缩小容积
A.②③ B.②③④ C.②③④⑤ D.④
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:实验题
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
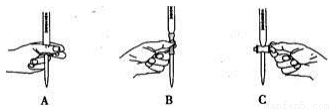
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 | |
体积(mL) | 浓度(mol•L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
(4)写出表中a 对应的实验目的 ;
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1次 | 第2 次 | 第3 次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示) 为 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++  =
=  Cl-+
Cl-+  Fe3++
Fe3++  .
.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
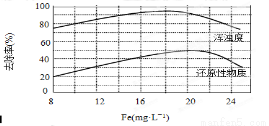
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com