
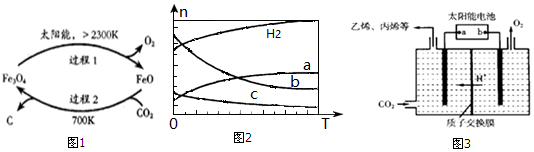
分析 (1)①从图1流程来看CO2~C~4mole-,据此进行分析;
②过程2是FeO和CO2反应生成Fe3O4和C;
(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;
②提高CO2的转化率,则平衡向正反应方向进行,并从影响平衡移动因素分析;
③可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
(3)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(4)①负极通燃料,正极通氧气;
②太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成.
解答 解:(1)①从图1流程来看CO2~C~4mole-,故捕获1molCO2转移电子的物质的量是4mol,故答案为:4mol;
②过程2是FeO和CO2反应生成Fe3O4和C,故化学方程式为6FeO+CO2=2Fe3O4+C,
故答案为:6FeO+CO2=2Fe3O4+C;
(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,故答案为:<;
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强减或者n(CO2)与n(H2)的投料比,都能使平衡向正反应方向进行,故答案为:AC;
③随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,故答案为:c;
(3)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159,5kJ/mol
2NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87KJ/mol;
(4)①负极通燃料,正极通氧气,故a是负极,故答案为:a;
②电解时,二氧化碳在b极上生成丙烯,得到电子的一极为电源的正极,电极反应式为:3CO2+18H++18e-=C3H6+6H2O,
故答案为:3CO2+18H++18e-=C3H6+6H2O.
点评 本题涉及氧化还原、化学平衡移动以及原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目为0.4NA | |
| B. | 28g聚乙烯中所含原子数为6NA | |
| C. | 0.1mol苯乙烯中含有双键的数目为0.4NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | C | |
| B |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
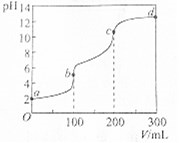 室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | a点溶液的pH=2,草酸溶液的浓度为0.005mol•L-1 | |
| B. | b点对应溶液中:c(Na+)>c(HC2O4-)>c(OH-)>c(C2O42-) | |
| C. | b→c段,反应的离子方程式为HC2O4-+OH-═C2O42-+H2O | |
| D. | c→d段,溶液中C2O42-的水解程度逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com