
| A. | 盐中一定含有金属元素 | B. | 氢化物一定是共价化合物 | ||
| C. | 碱中一定含有氢、氧元素 | D. | 能电离出H+的物质一定是酸 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
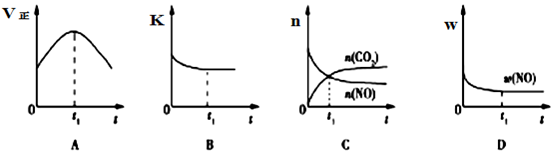
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建筑要使用大量的沙,常使用内陆河的河沙及海洋的海沙 | |
| B. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不相同 | |
| D. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
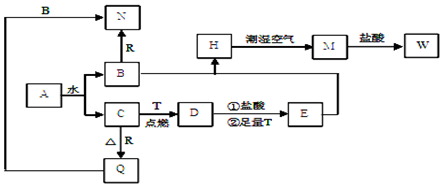

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 还原性:SO2>Fe2+>Cr3+ | B. | 氧化性:Cr2O72->SO2>Fe3+ | ||
| C. | Cr2O72-能将Na2SO3氧化成Na2SO4 | D. | 两个反应中Fe2(SO4)3均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
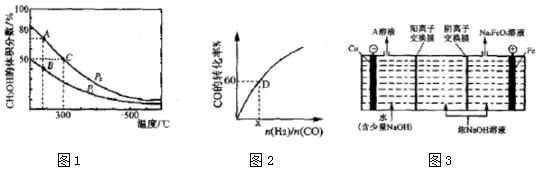
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com