
| A. | $\frac{1000ωνρ}{36.5}$mol/L | B. | $\frac{1000νρ}{36.5+22400}$mol/L | ||
| C. | $\frac{ων}{22.4(V+1)}$mol/L | D. | $\frac{1000νρ}{36.5V+22400}$mol/L |
分析 根据V=$\frac{m}{ρ}$可计算溶液的体积,根据c=$\frac{n}{V}$和$c=\frac{1000ρ?}{M}$可计算溶液的物质的量浓度.
解答 解:根据$c=\frac{1000ρ?}{M}$可知,盐酸的浓度是c=$\frac{1000ωρ}{36.5}$mol/L,故AC不正确;氯化氢的物质的量是$\frac{V}{22.4}$mol,质量是$\frac{V}{22.4}$×36.5g,溶剂的质量是1000g.所以溶液的体积是$\frac{36.5×\frac{V}{22.4}+1000}{ρ}mL$,所以溶液的浓度是$\frac{1000νρ}{36.5V+22400}$mol/L,所以B错误,
故选D.
点评 本题考查物质的量浓度的计算,题目难度中等,解答本题的关键是能把握相关计算公式的运用,易错点为相关单位的换算.


科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
将amol硫化亚铁放入含3a mol H2SO4的浓硫酸中,充分反应后,氧化、还原产物分别是Fe3+、S和SO2,则:①硫化亚铁全部溶解 ②放出的气体少于1.5a mol③反应过程中转移5a mol e- ④放出1.5a mol气体 ⑤无法确定。上述叙述正确的是
A.①② B.②③ C.①④ D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液显碱性:SO32-+2 H2O?H2SO3+2 OH- | |
| B. | 氯化银投入水中后建立平衡:AgCl (s)?Ag+(aq)+Cl-(aq) | |
| C. | 甲烷的燃烧热为890.3kJ•mol-1,表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中氮的化合价为-2价.
,其中氮的化合价为-2价.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
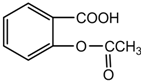 如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )
如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )| A. | 阿斯匹林的化学式为C9H8O4 | |
| B. | 该化合物具有酸性,能与 NaOH 或 NaHCO3反应 | |
| C. | 1 mol 该化合物与足量的 NaOH溶液反应,消耗 NaOH最大的物质的量为2 mol | |
| D. | 纯净的 Aspirin 不能与 FeCl3溶液反应,但它的水解产物能使FeCl3溶液显色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)为置换反应 | B. | (2)为化合反应 | ||
| C. | 只有(1)(3)为氧化还原反应 | D. | (1)(2)(3)均为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com