
| A.H + H = H—H | B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ | D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
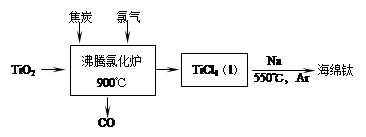

 ,下列说法正确的是 。
,下列说法正确的是 。| A.该反应正反应的ΔH>0 |
| B.在不同温度区域,TiI4的量保持不变 |
| C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区 |
| D.在提纯过程中,I2 可循环利用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
| 实验组 | T/℃ | 起始浓度/mol?L-1 | 等质量催化剂的 比表面积/m2?g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | | | 124 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.物质的燃烧一定是放热反应 |
| C.放热的化学反应不需要加热就能发生 |
| D.化学能与光能之间可以相互转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应必然引起物质状态的变化 |
| B.化学反应一定有化学键的断裂和生成 |
| C.需要加热的反应一定是吸热反应 |
| D.若反应物的总能量高于生成物的总能量,则该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解水生成氢气和氧气时,电能主要转化为化学能 |
| B.白炽灯工作时,电能全部转化为光能 |
| C.煤燃烧时,化学能主要转化为热能 |
| D.风力发电时,风能主要转化为电能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据 |
| B.热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 |
| C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而状态不同,ΔH也不相同 |
| D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com