
下表列出了A~R十种元素在周期表中的位置:
主族
周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA
2ERF
3ACDHIG
4B
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。
科目:高中化学 来源:2014年高中化学二轮创新训练上专题9常见金属元素及其重要化合物练习卷(解析版) 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。

已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cu2+ | 4.7 | 6.7 |
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质,用如图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:______________________、________________________;

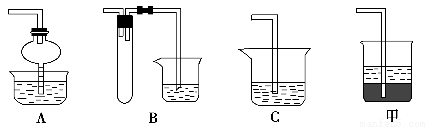
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中用碱液吸收处理,下列A、B、C装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是________。
(3)步骤②酸浸过程中,需要用到3 mol·L-1的盐酸100 mL,配制该盐酸时。除了用到烧杯、玻璃棒、胶头滴管外,还需要用到的仪器有________________。
(4)步骤④加入物质X的目的是______________________________________,物质X可以选用下列物质中的________。
A.氧化铜 B.稀盐酸
C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行________次过滤操作。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:选择题
常温下,0.1 mol·L-1 HX溶液的pH=1,0.1 mol·L-1 CH3COOH溶液的pH=2.9。下列说法不正确的是 ( )。
A.HX和CH3COOH均可抑制水的电离
B.取HCl与HX各0.1 mol溶于水配制成1 L混合溶液,则溶液的c(H+)=0.2 mol·L-1
C.等物质的量浓度、等体积的HX溶液与CH3COONa溶液混合后所得的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向等物质的量浓度、等体积的HX溶液和CH3COOH溶液中,分别加入一定物质的量浓度的NaOH溶液,欲使两者的pH均等于7,则消耗氢氧化钠溶液的体积:前者大于后者
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者强
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是 ( )。
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是( )。
A.1.5 mol NO2与足量的H2O反应,转移的电子数为NA
B.常温常压下,0.5NA个CO2分子质量为22 g
C.28 g氮气所含的原子数目为NA
D.在标准状况下,0.5NA个氯气分子所占体积是11.2 L
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题11常见有机化合物及其应用练习卷(解析版) 题型:选择题
下列各选项的两个反应属于同一反应类型的是 ( )。
选项反应Ⅰ反应Ⅱ
A在光照条件下,异丁烷与溴蒸气反应制取(CH3)3CBr将乙烯通入溴的四氯化碳溶液中制取1,2-二溴乙烷
B在镍作催化剂的条件下,苯与氢气反应生成环己烷在催化剂作用下,乙烯与水反应生成乙醇
C在银作催化剂的条件下,乙醇与空气中的氧气反应生成乙醛在一定条件下,由氯乙烯(CH2=CHCl)合成聚氯乙烯
D乙酸乙酯在酸的催化作用下与水反应生成乙酸和乙醇在一定条件下,液态油脂与氢气反应制造人造脂肪
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com