
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。
下列说法正确的是
A.对应简单离子半径:X>W
B.对应气态氢化物的稳定性Y>Z
C.化合物XZW既含离子键,又含共价键
D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:
下图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去)。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见 的无色液体。
的无色液体。
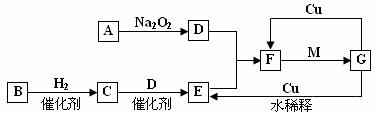
⑴ 物质F的化学式_ ⑵ 物质B的电子式__________
⑶ 写出C→E的化学方程式______________________________
⑷ 写出G→E的离子方程式______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH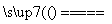 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111[ | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 ▲ 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ▲ ;不宜用盐酸的原因是 ▲ 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O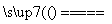 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 ▲ 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 ▲ 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
 Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 ▲ 。
②达到滴定终点的标志为 ▲ 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 ▲ 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其原因可能为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是
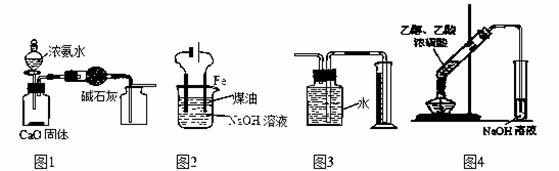
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置实验室制备Fe(OH)2
C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积
D.装置4可用于实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应
2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,能达到实验目的的是 ( )。
A.瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B.从B口进气,用排空气法收集CO2
C.瓶中盛满水,从B口进气,用排水法收集NO2
D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量 生成H2的体积

查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2 + 4OH- - 4e- = 4H2O;O2 + 2H2O + 4e- = 4OH-。据此作出判断,下列说法中错误的是:
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2+O2=2H2O
C.产物为无污染的水,属于环境友好电池
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,某恒定容积的密闭容器中发生如下可逆反应:CO(g)+H2(g)  C(s)+H2O(g);ΔH>0,以1 mol CO和2 mol H2为起始反应物,t1时达到平衡,生成0.5mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
C(s)+H2O(g);ΔH>0,以1 mol CO和2 mol H2为起始反应物,t1时达到平衡,生成0.5mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
A.t2时改变的条件可能是升高了温度或增大了压强
B.平衡后若加入少量炭,平衡向逆反应方向移动
C.平衡后若加入氢气,上述反应的ΔH会增大
D.起始时刻和达平衡后容器的压强之比为5∶6

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com