
| A. | 糖类、油脂和蛋白质均是高分子化合物 | |
| B. | 雾能产生丁达尔效应,雾属于胶体 | |
| C. | 新制氯水、HClO和SO2都有漂白作用 | |
| D. | 硝酸能与苯发生取代反应 |
分析 A.油脂的相对分子量较小,不属于高分子化合物;
B.胶体的微粒直径在1-100nm之间,根据微粒直径判断;
C.氯水含有次氯酸,次氯酸具有漂白性,二氧化硫能够与有色物质结合生成无色物质,从而具有漂白性;
D.浓硝酸与苯反应生成硝基苯的反应为取代反应.
解答 解:A.高分子化合物的相对分子质量达到10000以上,糖类、蛋白质是高分子化合物,而油脂不属于高分子化合物,故A错误;
B.雾的分散质粒子直径在1nm~100nm之间,所以雾属于胶体,故B正确;
C.新制氯水中含有HClO,HClO具有强氧化性,能够漂白有色物质;SO2能够与有色物质结合生成无色物质,从而能够漂白某些物质,故C正确;
D.硝酸能与苯发生反应生成硝基苯,该反应为取代反应,故D正确;
故选A.
点评 本题考查高分子化合物判断、有机反应类型判断、分散系分类等知识,题目难度不大,明确常见元素及其化合物性质为解答关键,注意掌握胶体的概念及判断方法,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ | |
| B. | Cl-的结构示意图: | |
| C. | 乙醇的结构式:C2H5OH | |
| D. | HOCH2COOH缩聚产物的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的结构式:C6H6 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 甲苯的分子式:C7H8 | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2与过量氯气 | B. | FeCl3溶液与过量铜片 | ||
| C. | FeCl3溶液与过量铁粉 | D. | FeSO4溶液与过量Zn粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
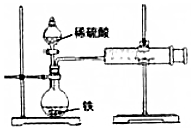 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com