
【题目】乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值。
Ⅰ.乙醇可以作为燃料燃烧。
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量。应用表中数据(25℃、101 kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式_____________。
键 | C—C | C—H | O=O | H—O | C—O | C=O |
键能/(kJmol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
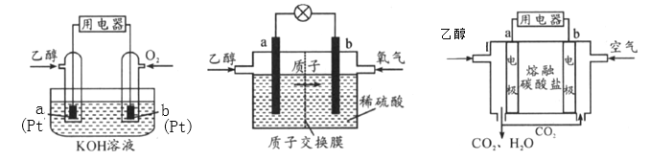
碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_________。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_________,通过质子交换膜的离子是_________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_________(填“a”或“b”)移动,电极b上发生的电极反应式为_________。
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g) + C2H4(g) ![]() CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
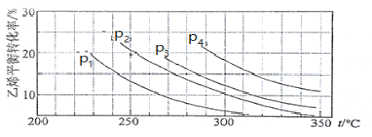
(1)图中压强P1、P2、P3、P4的大小顺序为:_________,理由是:_________。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。该条件下乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________、_________。
Ⅳ.探究乙醇与溴水是否反应。
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如下:
实验编号 | 实验步骤 | 实验现象 |
1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是_________。
②实验3的作用是_________。
③根据实验现象得出的结论是_________。
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应_________(已知若发生氧化反应,则Br2全部转化为HBr)。
【答案】(21分)
Ⅰ.C2H5OH(g) +3O2(g)=2CO2 (g)+ 3H2O(g) △H= -1253kJ/mol;
Ⅱ.(1)氧气;(2)C2H5OH+16OH--12e-=2CO32-+11H2O;空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)3O2+12H++12e-=6H2O;H+;
(4)a;O2+2CO2+4e-=2CO32-;
Ⅲ.(1)P4>P3>P2>P1;反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大;(2)增加H2O(g)的量、移出生成物;
Ⅳ.(1)①检验反应后溶液中是否还含有溴单质;
②对比实验,验证在加热条件下水是否能够与溴单质反应;
③加热条件下或长期放置,乙醇能够与溴水反应;
(2)取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br—物质的量。若n(Br—)=a mol则发生取代反应;若n(Br—)=2a mol则发生氧化反应;若a mol< n(Br—)< 2a mol则既发生了取代反应也发生了氧化反应;
【解析】
试题分析:Ⅰ.气态乙醇完全燃烧生成CO2和水蒸气的化学方程式为:C2H5OH(g) +3O2(g)=2CO2 (g)+ 3H2O(g),△H=反应物的键能之和-生成物的键能之和=[5×413+348+351+463+3×498]kJ/mol-[4×799+6×463]
Ⅱ.(1)燃料电池中通入燃料的为负极,通入氧气或空气的为正极,三种乙醇燃料电池中正极反应物均为氧气,故答案为:氧气;
(2)碱性乙醇燃料电池中,电极a为负极,电极反应式为C2H5OH+16OH--12e-=2CO32-+11H2O,使用空气代替氧气,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH,故答案为:C2H5OH+16OH--12e-=2CO32-+11H2O;空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)酸性乙醇燃料电池中,电极b为正极,电极反应式为3O2+12H+ +12e-= 6H2O;通过质子交换膜能够使质子通过,故答案为:3O2+12H+ +12e-= 6H2O;H+;
(4)根据图示,a为负极,原电池中阴离子由正极向负极移动,CO32-向电极a移动,电极b为正极,电极反应式为O2+ 2CO2 +4e-= 2CO32-,故答案为:a;O2+ 2CO2 +4e-= 2CO32-;
Ⅲ.(1)在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4,故答案为:p1<p2<p3<p4;反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大;
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等,
故答案为:将产物乙醇液化移去;增加H2O(g)的量;
Ⅳ.①溴水能够氧化碘化钾生成碘,实验2中向淀粉-KI溶液中滴加冷却后的混合液可以检验反应后溶液中是否还含有溴单质,故答案为:检验反应后溶液中是否还含有溴单质;
②实验3的作用是进行对比实验,验证在加热条件下水是否能够与溴单质反应,故答案为:对比实验,验证在加热条件下水是否能够与溴单质反应;
③根据实验②加入淀粉KI溶液,溶液颜色不变,说明混合液中不存在溴单质,说明加热条件下或长期放置,乙醇能够与溴水反应,故答案为:加热条件下或长期放置,乙醇能够与溴水反应;
(2)探究该反应是取代反应还是氧化反应,若是取代反应,含a mol Br2的溴水反应后生成a mol Br-,若是氧化反应,含a mol Br2的溴水反应后生成2a mol Br-,因此实验方案设计为:取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br—物质的量。若n(Br—)=a mol则发生取代反应;若n(Br—)=2a mol则发生氧化反应;若a mol< n(Br—)< 2a mol则既发生了取代反应也发生了氧化反应,故答案为:取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br—物质的量。若n(Br—)=a mol则发生取代反应;若n(Br—)=2a mol则发生氧化反应;若a mol< n(Br—)< 2a mol则既发生了取代反应也发生了氧化反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】50 mL物质的量浓度为4.4 mol/L,密度为1.24 g/mL的稀硫酸的质量分数为( )
A.35%
B.70%
C.17.5%
D.0.035%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
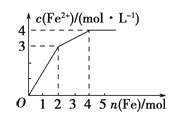
A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题。
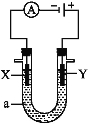
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
(1)电解池中X极上的电极反应式是 ,在X极附近观察到的现象是 。
(2)Y电极上的电极反应式是 ,检验该电极反应产物的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H9ClO2的有机物,能与NaHCO3溶液反应生成气体,则符合此条件的结构(不考虑立体异构)有
A. 9种 B. 10种 C. 11种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的物质,该物质是( )
A.甲烷 B.甲醛 C.氨气 D.二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P可用作光电材料,其合成路线如下:
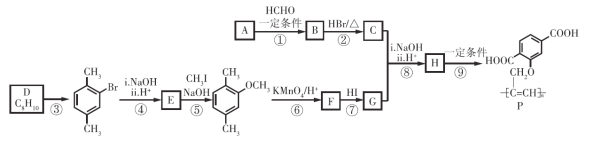
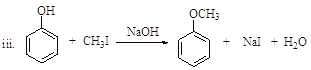
已知:![]() (R、R’表示氢或烃基)
(R、R’表示氢或烃基)
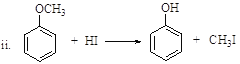
(1)烃A的相对分子质量是26,其结构简式是 。
(2)反应①的反应类型是 。
(3)C中含有的官能团是 。
(4)D为苯的同系物,反应③的化学方程式是 。
(5)G的结构简式是 。
(6)反应⑨的化学方程式是 。
(7)反应⑤和⑦的目的是 。
(8)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中的两对物质,都能用分液漏斗分离且油层由分液漏斗上口倒出的是( )
A.汽油和水、四氯化碳和水
B.汽油和水、苯和水
C.食用油和水、醋酸和水
D.葡萄糖和水、酒精和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com