
����Ŀ��ijʵ��С���������Ư���Ե�ʵ��̽��
��1����Ӧ��ͼ1��ʾ�ķ���ʵ�飬��������A����Ҫ�ɷ��������������ǿ�����ˮ�������ش��������⣺ 
�ٸ����о���ʵ�飩����ҪĿ���� ��
��Ũ����������� �� ���о�Ŀ��ֱ����ص�ʵ�������� ��
�۽�ʯ����Һ�ε�������ˮ�е����� ��
��2����Ϊ̽��SO2��Ư����SO2ֱ����������ɫ���ʣ�����SO2��ˮ��Ӧ�IJ���H2SO3�����ã������ͼ2װ�ý���ʵ�飺��ͼ2�������������������Ϊ70%�� ��Ϊ̽�������SO2 �ܲ���ʹƷ����ɫ����ָ����Ƶ�ʵ��װ��ͼ���������ԵIJ����е�һ��
�ڰ����ĺ��װ�ã�ʵ���п���SO2�Դ�Լÿ��3�����ݵ��ٶ�ͨ��Ʒ��ľƾ���Һʱ������һСʱ��Ʒ���Բ���ɫ����˵��Ʒ����ɫ��ԭ����SO2ֱ�ӵ��£����ԣ�SO2 ͨ��Ʒ��ˮ��Һ������Ʒ����ɫ�Ŀ����� �� ���ѧʽ��
���𰸡�
��1��̽��Cl2�ڳ�ʪ����ʱ�Ƿ����Ư���ԣ���������A�е�ˮ������ B�ڵ���ɫ��������ɫ,C�ڵ���ɫ������ɫ��ʯ����Һ�ȱ�����ɫ
��2��a��������û�и����ȱ�ٶ�������ĸ���װ�ã���bû��β������װ�ã� H2SO3
���������⣺��1���ٸ�ʵ��ͨ���۲����������ʪ�����ֱ����ɫ������Ư�����ã����о������������û��Ư���ԣ�
���Դ��ǣ�̽��Cl2�ڳ�ʪ����ʱ�Ƿ����Ư���ԣ�
��Ũ������������������ˮ�ԣ���������������A�е�ˮ����������ͨ��Aƿ��Ũ������Bƿ�и���IJ�������ɫ��˵����������û��Ư���ԣ�Cƿ��������ˮ������ˮ����ɫ������ɫ��˵��ʪ��������ɫ������Ư�����ã�
��ΪB�ڵ���ɫ��������ɫ��C�ڵ���ɫ������ɫ��
���Դ��ǣ���������A�е�ˮ������B�ڵ���ɫ��������ɫ��C�ڵ���ɫ������ɫ��
��������ˮ����H+��HClO��HClO����ǿ�����ԣ�Ư���ԣ��ʿ�ʹ��ɫʯ����Һ�ȱ�����ɫ�����Դ��ǣ�ʯ����Һ�ȱ�����ɫ����2���ٸ�ʵ����̽�������SO2�ܲ���ʹƷ����ɫ�����Զ�������ͨ��Ʒ����ҺǰҪ���и�����������ж������Զ������岻��ֱ���ſգ���Ҫ��β������װ�ã�
���Դ��ǣ�a��������û�и����ȱ�ٶ�������ĸ���װ�ã���bû��β������װ�ã�
�ڶ��������ˮ��Ӧ����������SO2+H2OH2SO3��������Ʒ����ɫ�Ŀ�����H2SO3�����Դ��ǣ�H2SO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά�����������������³´�л��Ԥ��������ά�����彡��������.����Ѫ֢����ȱ����ά������( )
A.����A
B.����B
C.����C
D.����D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.6g Na2CO3����ˮ���Ƴ�1 000mL��Һ������ȡ��20mL������Һ��Na+�����ʵ���Ũ��Ϊ��������
A.0.1 molL��1
B.0.2 molL��1
C.0.05 molL��1
D.0.025 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѪҺ��,�����Ԫ�غ���ƫ����������˥��,��������;�����Ԫ�غ���ƫ��,�ֻ�Ӱ�켡����Ĺ���,��ʱ����Ҫ�����.һЩҽ�ú��ػ������ˮ��Һ����AgNO3��Һ��Ӧ,���ɲ�����ϡ����İ�ɫ����,�û�������( )
A.KNO3
B.K2CO3
C.KCl
D.KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ��ѧ��Ӧ������ʽ��ʾ��A+B��C+D+H2O��ش��������⣺
��1����A��C��D��������Ԫ�أ���A�Ļ��ϼ۽���C��D֮�䣬д���÷�Ӧ�����ӷ���ʽ�� ��
��2����CΪ�Ȼ��ƣ�D��ʹ����ʯ��ˮ����ǵ���ζ���壬��A��B������ǣ��� ��
��3����AΪMnO2 �� BΪ���ᣬC�ǻ���ɫ�ĵ������壬д���÷�Ӧ�����ӷ��� ʽ ��
��4����AΪ���ʣ�BΪ���ᣬ��д��������ʽ�Ļ�ѧ����ʽ ��
��5����C��D��Ϊ�����Ҷ���ʹ����ʯ��ˮ����ǣ���D����ʹƷ����ɫ����A��B��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������̼����ȼ�ϵ����Li2CO3��K2CO3Ϊ����ʣ���C4H10Ϊȼ��ʱ���õ�ع���ԭ����ͼ������˵����ȷ���ǣ� �� 
A.aΪC4H10 �� bΪCO2
B.�����ڵ�����У�CO32���������ƶ�
C.�˵���ڳ���ʱҲ�ܹ���
D.ͨ�붡���һ���Ǹ������缫��ӦΪ��C4H10��26e��+13CO32��=17CO2��+5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ԫ�����ڱ���һ���֣��ش���������
���� | IA | ��A | ��A | ��A | ��A | ��A | ��A |
1 | |||||||
2 | �� | �� | �� | ||||
3 | �� | �� | �� | ||||
��1������Ԫ�آ�����⻯��ĵ���ʽΪ �� Ԫ�آۺ͢ݶ�Ӧ���⻯����ȶ�������д��ѧʽ����ͬ����Ԫ�آں͢�Ӧ����������ˮ�������Խ�ǿ���� ��
��2����ҵ�������ʢܵ�ԭ�������û�ѧ����ʽ��ʾ����
��3����֪ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ���Ԫ�آ���Ԫ�آܵ��������������Ƶ����ʣ�д��Ԫ�آٵ�����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��4��0.2mol�ĵ��ʢ���100mL2molL��1��FeBr2��Һ��Ӧ����������Fe2+��Br�������ʵ���֮���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�� ![]() ������R��R1��R2��R3��R4����ʾ������
������R��R1��R2��R3��R4����ʾ������
����A��K��11�ֲ�ͬ���л������֮���ת����ϵ���£�
����AΪ����1mol A�ɵ�2mol B��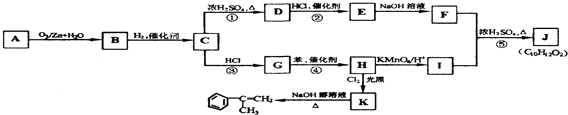
��ش��������⣺
��1��ָ����Ӧ�����ͣ��� ��
��2��E��ϵͳ����Ϊ ��
��3��A�Ľṹ��ʽΪ ��
��4��J��C10H12O2���ж���ͬ���칹�壮��J�б�����ֻ������ȡ���������ڶ�λ����1mol J���뺬2mol NaOH����Һ��ȫ��Ӧ��д����������Ҫ���J�����ֿ��ܽṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���������ڵĺ�������0.01%������ά����������ٽ����������м�����Ҫ�����á�������Ԫ�أ�����˵��������� ( )��
A.ʳ�üӵ�ʳ���Է�ֹ��ȱ����
B.ʹ���������˿��Լ���ƶѪ���ķ���
C.���ֿ�ѧ����ʳϰ�ߣ�ȫ�����������Ԫ��
D.��Ը���Ӫ��Ʒ����������Ԫ�ص�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com