
| A. | 1.4g | B. | 2.2g | C. | 2.8g | D. | 4.4g |
分析 根据反应中生成水的质量可确定乙醇的物质的量,进而求出碳原子的物质的量,同时也是CO2和CO的物质的量和,再根据二者总的质量求出平均摩尔质量,最后用十字交叉法解题.
解答 解:设乙醇的物质的量为x,
由C2H5OH~3H2O
1mol 54g
x 10.8g
$\frac{1}{x}=\frac{54}{10.8}$,
解得x=0.2mol,
由乙醇的分子式可知n(CO2)+n(CO)=0.2mol×2=0.4mol,
则m(CO2)+m(CO)=27.6g-10.8g=16.8g,则平均摩尔质量为$\frac{16.8g}{0.4mol}$=42g•mol-1,
由十字交叉法可知: ,
,
所以m(CO)=28g•mol-1×0.4mol×$\frac{2}{16}$=1.4g,
所以CO的质量为1.4g,
故选A.
点评 本题考查化学反应方程式的计算,为基础性习题,把握水的质量及CO、CO2的质量、守恒法计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 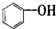 属于醇类化合物 属于醇类化合物 | B. | 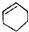 属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH3CH(CH3)2属于链状化合物 | D. |  属于脂环化合物 属于脂环化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
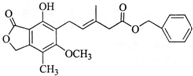
| A. | 该物质的分子式为C23H24O6 | |
| B. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
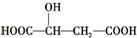 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
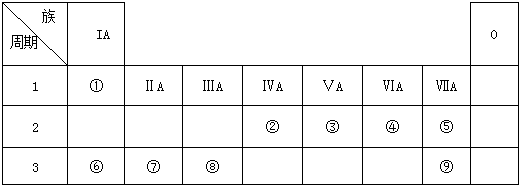
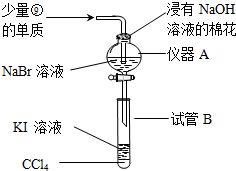
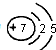 .
.
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子化合物 | ||
| C. | Tl(OH)3是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com