
£Ø16·Ö£©
£Ø1£©Š”Ć÷ŌŚ×ö”°ŃŠ¾æĪĀ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ”±ŹµŃ鏱£¬ĖūĶłĮ½Ö§ŹŌ¹Ü¾ł¼ÓČė4mL 0.01mol/LµÄKMnO4ĖįŠŌČÜŅŗŗĶ2mL 0.1mol/L H2C2O4£ØŅŅ¶žĖį£©ČÜŅŗ£¬Õńµ“£¬AŹŌ¹ÜÖĆÓŚČČĖ®ÖŠ£¬ BŹŌ¹ÜÖĆÓŚĄäĖ®ÖŠ£¬¼ĒĀ¼ČÜŅŗĶŹÉ«ĖłŠčµÄŹ±¼ä”£
¢ŁŠčŅŖÓĆ Ą“Ėį»ÆKMnO4ČÜŅŗ£¬ĶŹÉ«ĖłŠčŹ±¼ätA tB£ØĢī”°>”±”¢”°=”±»ņ”°<”±£©”£
¢ŚŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø2£©ŹµŃéŹŅÓŠĘæ»ģÓŠÄąÉ³µÄŅŅ¶žĖįѳʷ£¬Š”Ć÷ĄūÓĆÕāøö·“Ó¦µÄŌĄķĄ“²ā¶ØĘäŗ¬Į棬¾ßĢå²Ł×÷ĪŖ£ŗ
¢ŁÅäÖĘ250 mLČÜŅŗ£ŗ×¼Č·³ĘĮæ5.000gŅŅ¶žĖįѳʷ£¬Åä³É250mLČÜŅŗ”£
¢ŚµĪ¶Ø£ŗ×¼Č·ĮæČ”25.00 mLĖłÅäČÜŅŗӌ׶ŠĪĘæÖŠ£¬¼ÓÉŁĮæĖįĖį»Æ£¬½«0.1000 mol”¤L-1 KMnO4ČÜŅŗ×°Čė £ØĢī”°ĖįŹ½”±»ņ”°¼īŹ½”±£©µĪ¶Ø¹Ü£¬½ųŠŠµĪ¶Ø²Ł×÷”£
ŌŚŹµŃéÖŠ·¢ĻÖ£¬øÕµĪĻĀÉŁĮæKMnO4ČÜŅŗŹ±£¬ČÜŅŗŃøĖŁ±ä³É×ĻŗģÉ«”£½«×¶ŠĪĘæŅ”¶ÆŅ»¶ĪŹ±¼äŗó£¬×ĻŗģÉ«ĀżĀżĻūŹ§£»ŌŁ¼ĢŠųµĪ¼ÓŹ±£¬×ĻŗģÉ«¾ĶŗÜæģĶŹÉ«ĮĖ”£Ēė½āŹĶŌŅņ£ŗ £»µ± £¬Ö¤Ć÷“ļµ½µĪ¶ØÖÕµć”£
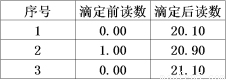
¢Ū¼ĘĖć£ŗ ÖŲø“ÉĻŹö²Ł×÷2“Ī£¬¼ĒĀ¼ŹµŃ鏿¾ŻČēĻĀ±ķ”£ŌņĻūŗÄKMnO4ČÜŅŗµÄĘ½¾łĢå»żĪŖ mL£¬“ĖѳʷµÄ“æ¶ČĪŖ ”££ØŅŃÖŖH2C2O4µÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ90£©
¢ÜĪó²ī·ÖĪö£ŗĻĀĮŠ²Ł×÷»įµ¼ÖĀ²ā¶Ø½į¹ūĘ«øߵďĒ ”£
A£®Ī“ÓƱź×¼ÅØ¶ČµÄĖįŠŌKMnO4ČÜŅŗČóĻ“µĪ¶Ø¹Ü B£®µĪ¶ØĒ°×¶ŠĪĘæÓŠÉŁĮæĖ®
C£®µĪ¶ØĒ°µĪ¶Ø¹Ü¼ā×ģ²æ·ÖÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§ D£®²»Š”ŠÄ½«ÉŁĮæĖįŠŌKMnO4ČÜŅŗµĪŌŚ×¶ŠĪĘæĶā
E£®¹Ū²ģ¶ĮŹżŹ±£¬µĪ¶ØĒ°ŃöŹÓ£¬µĪ¶Øŗóø©ŹÓ
£Ø1£©¢ŁĮņĖį£¬<£»¢Ś5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O£»£Ø2£©¢ŚĖįŹ½£¬·“Ó¦ÖŠÉś³ÉµÄMn2+¾ßÓŠ“ß»Æ×÷ÓĆ£¬ĖłŅŌĖęŗóĶŹÉ«»į¼Óæģ£»µĪČė×īŗóŅ»µĪĖįŠŌKMnO4ČÜŅŗ£¬×¶ŠĪĘæÖŠČÜŅŗ“ÓĪŽÉ«±äĪŖĒ³×ĻŗģÉ«£¬ĒŅ°ė·ÖÖÓÄŚ²»ĶŹÉ«£»¢Ū20.00mL£¬90.00%£»¢ÜA”¢C”¢D”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©¢ŁÓÉÓŚĻõĖįÓŠĒæµÄŃõ»ÆŠŌ£¬²»ÄÜĖį»ÆKMnO4ČÜŅŗ£¬ŃĪĖįÓŠ»¹ŌŠŌ£¬»į±»KMnO4ČÜŅŗŃõ»Æ£¬Ņņ“ĖŠčŅŖÓĆĮņĖįĖį»ÆKMnO4ČÜŅŗ£»ÓÉÓŚĪĀ¶ČÉżøߣ¬»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ£¬ĖłŅŌ·“Ó¦Ź±¼ä¾ĶŌ½¶Ģ£¬Ņņ“ĖĶŹÉ«ĖłŠčŹ±¼ätA<tB; ¢Śøł¾Żµē×ÓŹŲŗć”¢µēŗÉŹŲŗć¼°Ō×ÓŹŲŗćæɵĆøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ5H2C2O4+2MnO4-+ 6H+=10CO2+2Mn2++8H2O£»£Ø2£©¢ŚKMnO4ČÜŅŗÓŠĒæŃõ»ÆŠŌ£¬»įøÆŹ“Ļš½ŗ£¬ĖłŅŌKMnO4ČÜŅŗÓ¦øĆ×°ČėĖįŹ½µĪ¶Ø¹ÜÖŠ£¬ŌŚŹµŃéÖŠ·¢ĻÖ£¬øÕµĪĻĀÉŁĮæKMnO4ČÜŅŗŹ±£¬ČÜŅŗŃøĖŁ±ä³É×ĻŗģÉ«”£½«×¶ŠĪĘæŅ”¶ÆŅ»¶ĪŹ±¼äŗó£¬×ĻŗģÉ«ĀżĀżĻūŹ§£»ŌŁ¼ĢŠųµĪ¼ÓŹ±£¬×ĻŗģÉ«¾ĶŗÜæģĶŹÉ«ĮĖæÉÄܵÄŌŅņŹĒ·“Ó¦ÖŠÉś³ÉµÄMn2+¾ßÓŠ“ß»Æ×÷ÓĆ£¬ĖłŅŌĖęŗóĶŹÉ«»į¼Óæģ£»µ±µĪČė×īŗóŅ»µĪĖįŠŌKMnO4ČÜŅŗ£¬×¶ŠĪĘæÖŠČÜŅŗ“ÓĪŽÉ«±äĪŖĒ³×ĻŗģÉ«£¬ĒŅ°ė·ÖÖÓÄŚ²»ĶŹÉ«£»¢Ū·ÖĪö3“ĪŹµŃéµÄĢå»żŹż¾Ż£¬æÉÖŖ£ŗµŚČż“ĪĪó²īĢ«“ó£¬ŅŖÉįČ„£¬ĻūŗĵÄKMnO4ČÜŅŗµÄĢå»żŹĒV(KMnO4)=(20.10+19.90)ml”Ā2=20.00ml£»n(KMnO4)= 0.1000 mol/L ”Į 0.020 L=2”Į10-3mol;øł¾Ż·½³ĢŹ½æÉÖŖn(H2C2O4)= 5/2 n(KMnO4)= 5/2”Į2”Į10-3mol=5”Į10-3mol”£ĖłŅŌH2C2O4µÄÖŹĮæŹĒm=5”Į10-3mol ”Į90g/mol=0.45g,ĖłŅŌ²ŻĖįµÄ“æ¶ČŹĒ0.45g”Ā(5.000g”Ā10) ”Į 100%=90.00%£»¢ÜA£®Ī“ÓƱź×¼ÅØ¶ČµÄĖįŠŌKMnO4ČÜŅŗČóĻ“µĪ¶Ø¹Ü£¬Ōņ±ź×¼ČÜŅŗµÄÅضČĘ«Š”£¬ŹĒĻūŗĵÄĢå»żĘ«“ó£¬Ōņ¼ĘĖćµÄ²ŻĖįµÄĪļÖŹµÄĮæĘ«“ó£¬ÕżČ·£»B£®µĪ¶ØĒ°×¶ŠĪĘæÓŠÉŁĮæĖ®£¬²»»į²śÉśČĪŗĪÓ°Ļģ£¬“ķĪó£»C£®µĪ¶ØĒ°µĪ¶Ø¹Ü¼ā×ģ²æ·ÖÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§£¬ŌņĻūŗĵıź×¼ČÜŅŗĢå»żĘ«“ó£¬ĖłŅŌ¼ĘĖćµÄ²ŻĖįµÄÅØ¶Č¾ĶĘ«øߣ¬ÕżČ·£»D£®²»Š”ŠÄ½«ÉŁĮæĖįŠŌKMnO4ČÜŅŗµĪŌŚ×¶ŠĪĘæĶā£¬ŌņĻūŗĵıź×¼ČÜŅŗĢå»żĘ«¶ą£¬Ź¹²ŻĖįµÄÅضČĘ«øߣ¬ÕżČ·£»E£®¹Ū²ģ¶ĮŹżŹ±£¬µĪ¶ØĒ°ŃöŹÓ£¬µĪ¶Øŗóø©ŹÓ£¬ŌņĻūŗĵıź×¼ČÜŅŗĢå»żĘ«Š”£¬ĖłŅŌŹĒ²ŻĖįČÜŅŗµÄÅضČĘ«Š”£¬“ķĪó”£
æ¼µć£ŗæ¼²éµĪ¶Ø·½·ØŌŚĪļÖŹµÄĮæÅØ¶ČµÄ¼ĘĖćÖŠµÄÓ¦ÓĆ”¢Īó²ī·ÖĪö”¢Ąė×Ó·½³ĢŹ½µÄŹéŠ“µÄÖŖŹ¶”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ½ĖÕŹ”¶«ĢØŹŠø߶žµŚŅ»Ń§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
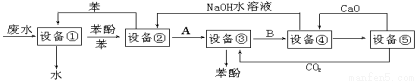
£Ø10·Ö£©ŗ¬±½·ÓµÄ¹¤Ņµ·ĻĖ®µÄ·½°øČēĻĀĶ¼ĖłŹ¾£ŗ
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Éč±ø¢Ł½ųŠŠµÄŹĒ ²Ł×÷£ØĢīŠ“²Ł×÷Ćū³Ę£©£¬ŹµŃéŹŅÕāŅ»²½²Ł×÷ĖłÓƵÄŅĒĘ÷ŹĒ ”£
£Ø2£©ÓÉÉč±ø¢Ś½ųČėÉč±ø¢ŪµÄĪļÖŹAŹĒ £¬ÓÉÉč±ø¢Ū½ųČėÉč±ø¢ÜµÄĪļÖŹBŹĒ ”£
£Ø3£©ŌŚÉč±ø¢ŪÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø4£©ŌŚÉč±ø¢ÜÖŠ£¬ĪļÖŹBµÄĖ®ČÜŅŗŗĶCaO·“Ó¦£¬²śĪļŹĒ ”¢ ŗĶĖ®£¬ŌŁĶعż¹żĀĖµĆ²śĪļ”£
£Ø5£©ÉĻĶ¼ÖŠ£¬ÄÜŃ»·Ź¹ÓƵÄĪļÖŹŹĒC6H6”¢CaO”¢ ”¢ ”£
£Ø6£©Š“³öĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄ±½·ÓµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ŹĒ ”£
¢ŁŗĖ“Ź²ÕńĒāĘ×Ö»ÓŠŅ»øö·å ¢Ś·Ö×ÓÖŠĪŽĢ¼Ģ¼Ė«¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ½ĖÕŹ”¶«ĢØŹŠøßŅ»µŚŅ»Ń§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĪļÖŹÖŠ£¬²»»į³öĻÖ¶”“ļ¶ūĻÖĻóµÄŹĒ
¢ŁĒāŃõ»ÆĢś½ŗĢå ¢ŚĖ® ¢Ū¶¹½¬ ¢ÜÕįĢĒČÜŅŗ ¢ŻFeCl3ČÜŅŗ ¢ŽŌĘ”¢Īķ
A£®¢Ś¢Ü¢Ż B£®¢Ū¢Ü C£®¢Ś¢Ü¢Ž D£®¢Ł¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”½ŅŃōŹŠø߶žµŚŅ»Ń§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŹµŃéŹŅÖĘCl2µÄ·“Ó¦ĪŖ4HCl(ÅØ)+MnO2 = MnCl2+C12”ü+2H2O£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A£®»¹Ō¼ĮŹĒHCl£¬Ńõ»Æ¼ĮŹĒMnO2
B£®ĆæÉś³É1 molCl2£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ2 mol
C£®ĆæĻūŗÄ1 molMnO2£¬Ęš»¹Ō¼Į×÷ÓƵÄHClĻūŗÄ4mol
D£®Éś³ÉµÄCl2ÖŠ£¬³żŗ¬ÓŠŅ»Š©Ė®ÕōĘųĶā£¬»¹ŗ¬ÓŠHClŌÓÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”½ŅŃōŹŠø߶žµŚŅ»Ń§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³ų·æÖŠµÄ»ÆѧÖŖŹ¶ŗܶą£¬ĻĀĆęŹĒÓŠ¹Ų³ų·æÖŠµÄ³£¼ū²Ł×÷»ņÕß³£¼ūĻÖĻó£¬ĘäÖŠ²»ŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ
A£®ÓĆŹ³“×ĒåĻ“ČČĖ®ĘæÖŠµÄĖ®¹ø
B£®µćČ¼ĢģČ»Ęų(Ö÷ŅŖ³É·ÖĪŖ¼×Ķé£ŗCH4)ĪŖ³“²ĖĢį¹©ČČĮæ
C£®ÉÕ²ĖÓĆ¹żµÄĢś¹ų£¬¾·ÅÖĆ³£³öĻÖŗģ×ŲÉ«°ß¼£
D£®¹āĮĮµÄĀĮÖĘĘ·±ķĆęŗÜČŻŅ×ø²øĒŅ»²ć±£»¤Ä¤
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĄķ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ 
A£®Ä³·“Ó¦µÄ·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾£¬ÓÉÓŅÉĻĶ¼·ÖĪöæÉÖŖ“߻ƼĮ²»øı䷓ӦµÄģŹ±ä
B£®³£ĪĀĻĀNaÓė×ćĮæO2·“Ӧɜ³ÉNa2O£¬ĖęĪĀ¶ČÉżøßÉś³ÉNa2OµÄĖŁĀŹÖš½„¼Óæģ
C£®ŅŃÖŖ£ŗ
¹²¼Ū¼ü | C£C | C=C | C£H | H£H |
¼üÄÜ/ kJ”¤mol-1 | 348 | 610 | 413 | 436 |
ŌņæÉŅŌ¼ĘĖć³ö·“Ó¦  µÄ¦¤HĪŖ£384 kJ”¤mol-1
µÄ¦¤HĪŖ£384 kJ”¤mol-1
D. ³£ĪĀĻĀŌŚ0.10 mol”¤L-1µÄ°±Ė®ÖŠ¼ÓČėÉŁĮæNH4Cl¾§Ģ壬NH3”¤H2OµÄµēĄė³Ģ¶ČŗĶČÜŅŗµÄpH¾ł¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĄķ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
½«ĒāŃõ»ÆÄĘĻ”ČÜŅŗµĪ¼Óµ½“×ĖįĻ”ČÜŅŗÖŠ£¬ĻĀĮŠø÷Ź¾ŅāĶ¼»ģŗĻČÜŅŗÓŠ¹ŲĮæ»ņŠŌÖŹµÄ±ä»ÆĒ÷ŹĘ£¬ĘäÖŠ“ķĪóµÄŹĒ




²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĪÄ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĪŖ½ā¾öČ«ĒņÄÜŌ“Óė»·¾³ĪŹĢā£¬½ŚÄܼõÅÅŅŃ³É¹²Ź¶”£ĻĀĮŠ“ėŹ©ÓŠĄūÓŚ½ŚÄܼõÅŵÄÓŠ
A£®¾ŁŠŠ”°µŲĒņŅ»Š”Ź±”±ĻØµĘ»ī¶Æ
B£®Ā¶Ģģ·ŁÉÕµ¾²ŻŗĶ½ÕøŃ
C£®ĻÄĢģ½«æÕµ÷µÄĪĀ¶ČÉčÖĆŌŚ26”ęŅŌÉĻ
D£®Éś»īĄ¬»ų·ÖĄą»ŲŹÕ“¦Ąķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ£ØĪÄ£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĢĒĄą”¢ÓĶÖ¬ŗĶµ°°×ÖŹµÄ¹²Ķ¬ĢŲµćŹĒ
A£®¾łŹĒøß·Ö×Ó»ÆŗĻĪļ B£®³£ĪĀĻĀ£¬ÓöµāĖ®¾ł»įĻŌĄ¶É«
C£®¾łÖ»ŗ¬ÓŠC”¢H”¢OČżÖÖŌŖĖŲ D£®¾łŹĒÉśĆü»ī¶Æ±Ų²»æÉÉŁµÄĪļÖŹ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com