
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的脱氧剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 过滤用到的玻璃仪器有铁架台、烧杯、漏斗、玻璃棒、滤纸 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Na2O2是氧化剂,CO2是还原剂 | |
| B. | 1mol Na2O2参加反应,有2mole-转移 | |
| C. | Na2O2晶体中阴阳离子个数比为1:1 | |
| D. | Na2O2晶体中含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 升温可让吸热反应加快速率,而会让放热反应减慢速率 | |
| D. | 通过增大浓度、升高温度、增大压强都可以使反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
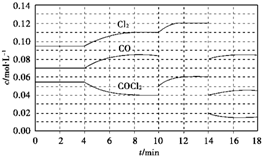
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
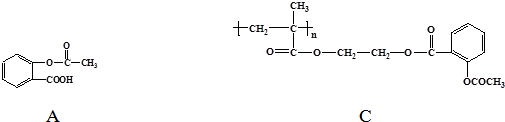
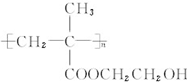 .
.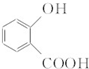 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2B6 | B. | A2B3 | C. | A3B | D. | AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
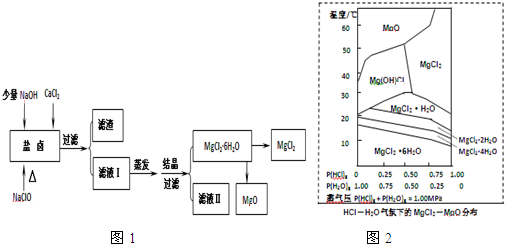
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com