
| A. | 天然气用于民用燃料 | B. | 纯酒精用作医用消毒 | ||
| C. | 来苏水用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
科目:高中化学 来源: 题型:选择题
| A. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O | |
| B. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
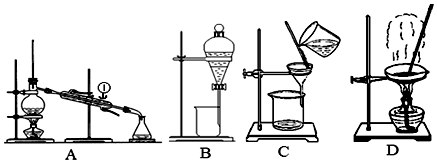
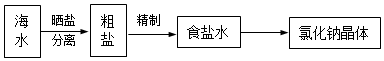
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
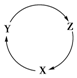 下列各组物质中,满足如图物质一步转化关系的选项是( )
下列各组物质中,满足如图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | S | SO2 | SO3 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g石墨和C60的混合固体中,含NA个碳原子 | |
| B. | 标准状况下,2.24L水中含有0.1NA个水分子 | |
| C. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| D. | 5.6g铁在足量氯气中燃烧,电子转移数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向纯水中加入少量氢氧化钠固体,c(H+)减小,Kw不变 | |
| D. | 向纯水中加入盐酸,将抑制水的电离,Kw变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
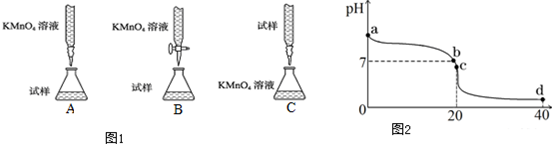
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com