
| A. | 用硫酸酸化高锰酸钾溶液,能起到增强氧化性作用 | |
| B. | 向某溶液中加入稀NaOH溶液未能产生使湿润的红色石蕊试变蓝的气体,说明原溶液中不含NH4+ | |
| C. | 在坩埚中加热MgCl2•6H2O晶体可以得到无水MgCl2 | |
| D. | 向某溶液中加入稀盐酸能产生使品红溶液褪色的气体,说明原溶液中一定含有SO32- |
分析 A.酸性条件下,高锰酸钾具有强氧化性;
B.氨气易溶于水;
C.加热时氯化镁易水解;
D.可能为HSO3-等.
解答 解:A.酸性条件下,高锰酸钾具有强氧化性,用硫酸酸化,可增大高锰酸钾的氧化性,注意不能用盐酸,故A正确;
B.氨气易溶于水,直接加热稀氢氧化钠溶液不能得到氨气,应用氢氧化钠浓溶液且加热,故B错误;
C.加热时氯化镁易水解,应在氯化氢氛围中加热,故C错误;
D.能使品红褪色的不一定为二氧化硫,且生成二氧化硫的也不一定为SO32-,也可能为HSO3-等,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的检验,盐类水解以及物质的性质等,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握的性质以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 天然气的主要成分是甲烷,它属于不可再生能源 | |
| B. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| C. | 石油分馏得到的汽油、煤油、柴油等都有混合物,没有固定的熔沸点 | |
| D. | 石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
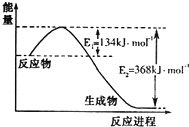 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1) | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
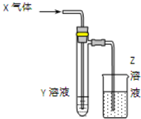 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去氯气中的HCl气体 | |
| B. |  分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色 | |
| D. | 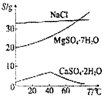 溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
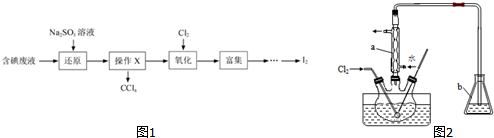
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
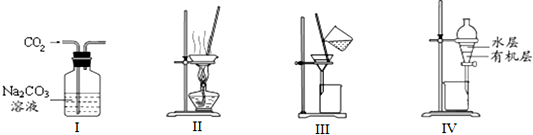
| A. | 用图I除去CO2中含有的少量Cl2 | |
| B. | 用图Ⅱ蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 用图Ⅲ分离NaCl和Na2SO4的混合溶液 | |
| D. | 用图Ⅳ分离CCl4萃取碘水中的碘后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
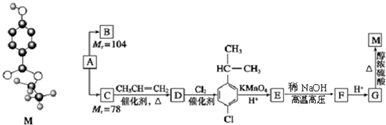
 .
.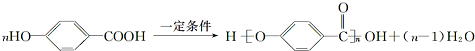 .
.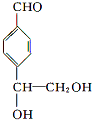 等.
等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com