
| A. | HNO3 | B. | H2SO4 | C. | NaClO | D. | H3PO4 |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol | B. | 0.8mol | C. | 0.6mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
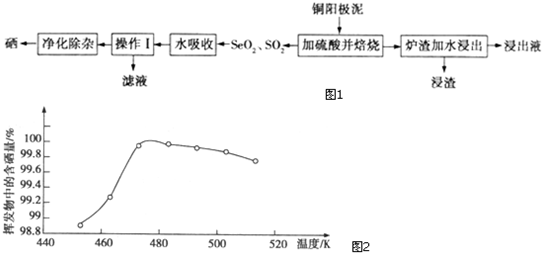
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的PH | 4.79 | 4.62 | 4.55 | 4.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com