
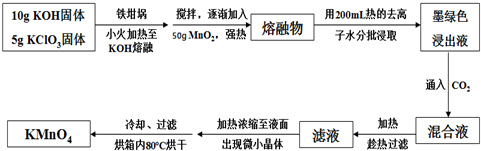
分析 (1)瓷坩埚原料含有SiO2,高温下与KOH发生反应;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色溶液中含有K2MnO4,KCl,由元素守恒可知,还会生成H2O;
工艺流程可知,CO2使MnO42-发生歧化反应生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多会生KHCO3;
(3)温度过高KMnO4发生分解反应生成锰酸钾、二氧化锰与氧气;过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗;加热时用玻璃棒不断搅拌,受热均匀利于蒸发溶剂,防止液体飞溅;洗涤KMnO4晶体用冷水洗涤,降低溶解度,减少因溶解导致的损失;
(4)生成K2MnO4的反应为:KClO3+3MnO2+6KOH $\frac{\underline{\;熔融\;}}{\;}$KCl+3K2MnO4+3H2O,通入二氧化碳时,MnO42-→MnO4-,MnO42-→MnO2,根据电子转移守恒2n(MnO2)=n(MnO4-),根据锰元素守恒可知,转化KMnO4的MnO42-占$\frac{2}{3}$,可得关系式:KClO3~3K2MnO4~2KMnO4,根据关系式计算.
解答 解:(1)坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,
故答案为:SiO2+2KOH$\frac{\underline{\;强热\;}}{\;}$K2SiO3+H2O;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色溶液中含有K2MnO4,KCl,由元素守恒可知,还会生成H2O,反应方程式为:KClO3+3MnO2+6KOH $\frac{\underline{\;熔融\;}}{\;}$KCl+3K2MnO4+3H2O,
工艺流程可知,CO2使MnO42-发生歧化反应生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多会生KHCO3,会有KHCO3晶体和KMnO4晶体一起析出,
故答案为:KClO3+3MnO2+6KOH $\frac{\underline{\;熔融\;}}{\;}$KCl+3K2MnO4+3H2O;KHCO3;
(3)温度过高KMnO4发生分解反应:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$O2↑+MnO2+K2MnO4,故在加热、浓缩、烘干的过程中温度不宜过高;过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗;加热时用玻璃棒不断搅拌,受热均匀利于蒸发溶剂,防止液体飞溅;洗涤KMnO4晶体用冷水洗涤,降低溶解度,减少因溶解导致的损失,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$O2↑+MnO2+K2MnO4;玻璃棒、漏斗;受热均匀利于蒸发溶剂;减少高锰酸钾的溶解;
(4)生成K2MnO4的反应为:KClO3+3MnO2+6KOH $\frac{\underline{\;熔融\;}}{\;}$KCl+3K2MnO4+3H2O,通入二氧化碳时,MnO42-→MnO4-,MnO42-→MnO2,根据电子转移守恒2n(MnO2)=n(MnO4-),根据锰元素守恒可知,转化KMnO4的MnO42-占$\frac{2}{3}$,可得关系式:KClO3~3K2MnO4~2KMnO4,
设12.25g KClO3固体经过上述转化,最多可制得KMnO4的质量为x,则:
KClO3~3K2MnO4~2KMnO4
122.5 316
12.25g x
所以x=$\frac{12.25g×316}{122.5}$=31.6g
故答案为:31.6.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、氧化还原反应、物质分离提纯、工艺条件的控制等,难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键 | |
| B. | 苯可以使溴水褪色,是发生了加成反应 | |
| C. | 乙醛在一定条件下与氧气反应生成乙酸,乙醛发生了氧化反应 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子数之比为1:2 | |
| B. | 它们的中子数之比为5:8 | |
| C. | 它们的电子数之比为1:2 | |
| D. | 分别与1mol钠反应,生成气体的质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
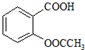 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1: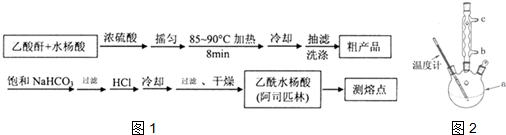
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
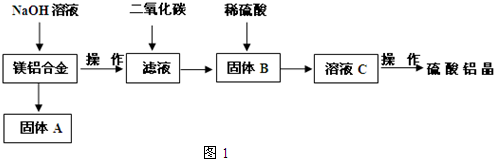
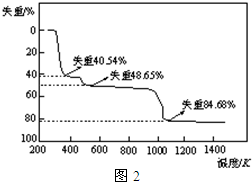 (5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
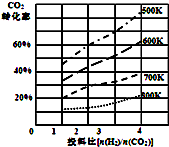 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
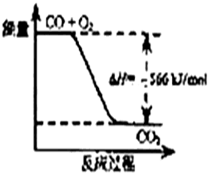
| A. | CO的燃烧热为283 kJ/mol | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com