
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 4.00×10-3 | 120 | ||
| Ⅲ | 探究温度对反应速率的影响 | 360 | 80 |

分析 (1)实验Ⅰ为参照实验,根据实验Ⅰ、Ⅱ中的不同因素判断实验目的,再根据对照试验中变量的唯一性判断温度;根据实验Ⅰ、Ⅲ的实验目的及对照试验中变量的唯一性判断NO、CO的浓度;
(2)根据图象中数据计算出反应过程中消耗CO的浓度,然后根据反应方程式得出反应消耗NO浓度,从而得出达到平衡时NO浓度;
(3)根据实验Ⅰ、Ⅱ可知,实验Ⅱ优先达到平衡,说明实验Ⅱ中反应速率较快;
(4)根据实验Ⅰ、Ⅲ可知,实验Ⅲ中达到平衡时CO浓度增大,说明升高温度,平衡向着逆向移动,NO的转化率减小.
解答 解:(1)对照实验中只能有1个变量,根据实验Ⅰ、Ⅱ可知,实验Ⅰ、Ⅱ的目的是探究催化剂的比表面积对反应速率的影响,则实验Ⅰ、Ⅱ的温度、NO初始浓度、CO初始浓度都必须完全相同,所以实验Ⅱ中温度为280℃;
实验Ⅰ、Ⅲ是探究温度对反应速率的影响,则除了温度不同以外,其它条件必须完全相同,则NO初始浓度为6.50×10-3mol/L、CO初始浓度为4.00×10-3mol/L,
故答案为:
| Ⅱ | 探究催化剂比表面积对反应速率的影响 | 280 | |||
| Ⅲ | 6.50×10-3 | 4.00×10-3 |
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,熟练掌握温度、压强、催化剂对反应速率的影响为解答关键,注意明确对照试验中必须满足变量的唯一性,试题充分考查了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第1组反应的其余产物只有H2O | |
| B. | 第2组反应中Cl2与FeBr2的物质的量之比可能等于1:2 | |
| C. | 第3组反应中生成22.4L,一定转移电子2mol | |
| D. | 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
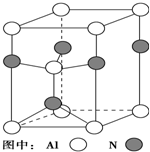 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示
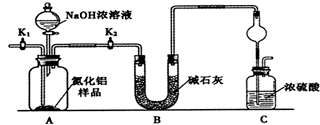
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
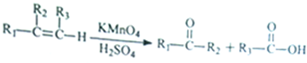 由
由 到
到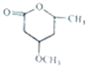 的合成路线如下所示:
的合成路线如下所示:
 ;B
;B ;C
;C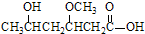 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
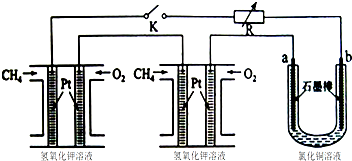
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com