
【题目】下表是元素周期表的一部分,表中所列的字母分别表示一种化学元素。

(1)下列 ______(填写编号)组元素可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A、原子核对核外电子的吸引力;B、形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ/mol):
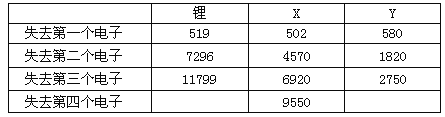
①表中X可能为以上13种元素中的________________(用化学用语表达)元素。用元素符号表示X和j形成化合物的化学式___________________;Y是周期表中_____________族元素。
②以上13种元素中,__________(用化学用语表达)元素原子失去核外第一个电子需要的能量最多。
③通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:_________________________________。
【答案】 ①④ Na Na2O或Na2O2 IIIA Ar 因为首先失去的电子是能量最高的电子,故第一电离能较小,以后再失去电子都是能级较低的电子,所需要的能量多;同时Li原子失去一个电子后,Li+已经形成稳定结构,此时再失去一个电子很困难
【解析】(1)①中a、c、h三种元素分别为钠、镁、碳,前两个为金属导电,碳可能为石墨,也是电的良导体,①正确;②中b为氢,H2不导电,g、k处于金属与非金属交界处,为半导体,②错误;③中c、h、l分别为镁、碳、氯,氯气不导电,③错误;④中d为锶、e为过渡金属元素,两者均导电,f为铝可以导电,④正确,故正确的答案为①④。
(2)①X的第二电离能远远大于第一电离能,所以X原子最外层为1个电子,且X的第一电离能小于Li的第一电离能,所以X的原子核对最外层电子的吸引力小于Li原子核对最外层电子的吸引力,所以X原子的电子层比Li多,故X为Na元素;j为O元素,所以Na和O形成的化合物的化学式为Na2O或Na2O2;Y只能失去三个电子,且第一、二、三电离能相差不大,所以Y最外层有3个电子,故Y属于第IIIA元素。②稀有气体元素原子最外层已达2个或8个电子的稳定结构,失去电子非常困难,需要的能量最多,以上13种元素中,m元素为Ar元素,是稀有气体元素,所以答案为Ar。 ③因为首先失去的电子是能量最高的电子,故第一电离能较小,以后再失去电子都是能级较低的电子,所需要的能量多;同时Li原子失去一个电子后,Li+已经形成稳定结构,此时再失去一个电子很困难。


科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为测定一种气态烃A的化学式,取标准状况下一定体积的A置于密闭容器中,再通入一定体积的O2,用电火花引燃,定性实验表明产物是CO2、CO和水蒸气。相关方案如下:(箭头表示气体流向,实验前系统内空气已排除)
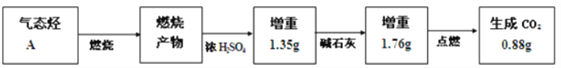
试回答(不要求写计算过程):A的实验式(最简式)是____________,根据所学知识,气态烃A的分子式为___________。
(2)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某有机物,化学式为C6H12。已知该物质可能存在多种结构,a、b、c是其中的三种,请根据下列要求填空:
①a与氢气加成生成2―甲基戊烷,则a的可能结构有___________种。
②b能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则b的结构简式为:__________________,其命名为:______________。
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则c的结构简式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D代表4种元素。请填空:
(1)A原子序数为24的元素原子中有___________个电子层,___________个能级,_________个未成对电子,位于元素周期表的___________区。
(2)B的原子的2p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:__________________________________。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的___________键更稳定(填“σ”或“π”)。
D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,D元素基态原子的电子排布式为____________________________,其单质在一定条件下能与浓硫酸反应,试写出该反应方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能正确表示水解的离子方程式是( )
A. CH3COOH + H2O ![]() CH3COO- + H3O+
CH3COO- + H3O+
B. Br- + H2O ![]() HBr + OH-
HBr + OH-
C. CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D. NH4+ + H2O ![]() NH3·H2O + H+
NH3·H2O + H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属银、熔融硫和多硫化锂分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列关于其说法错误的是
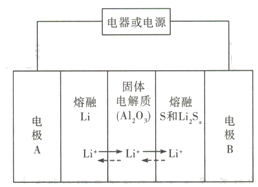
A. 放电时,电极B为正极
B. 充电时内电路中Li+的移动方向为从B到A
C. 该电池的适宜工作温度应该在Al2O3的熔点和沸点之间
D. 充电时,阳极反应为Sx2--2e-=xS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素性质对比正确的是
A. 金属性:K>Na>Cs B. 稳定性:SiH4>H2S>HCl
C. 酸性:H2CO3>H2SiO3>HClO4 D. 非金属性:Cl>S>P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com