
����Ŀ���������δ������£�����������Ϊԭ�ϣ�˫��ˮΪ�������ɺϳɻ��������ᡣ��������ת���ʺͻ���������ѡ�������¶Ⱥʹ��������ı仯��ͼ��ʾ(��������������ͬ)������˵������ȷ����( )
![]()
![]()
![]()
![]()
![]()
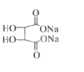
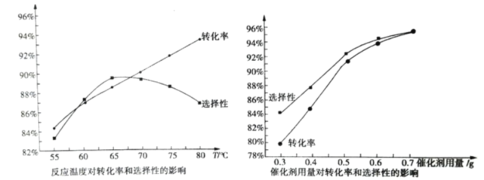
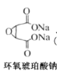
A.�����������ѡ������������������Ӷ����ӣ��ʴ�������Խ��Խ��
B.���¶ȵ��� 65��ʱ�������������ѡ�������¶����߶�����
C.���ߵ�һ���¶Ⱥ����������ѡ���Խ��ͣ�ԭ������ǻ��������ᷢ����ˮ�ⷴӦ
D.��ʵ�����˵ķ�Ӧ�¶�Ϊ 65��
���𰸡�A
��������
A��ͼ��仯��������ѡ���Դﵽһ���̶�ʱ�����Ӵ��������������������ѡ�������Ӳ����ǵ��ɱ��;���Ч�棬����һζ�Ӵ��������������A����
B��ͼ�������֪���¶ȵ��� 65��ʱ�������������ѡ�������¶����߶�����B��ȷ��
C���¶����ߴٽ�ˮ�⣬���»��������ᷢ���˸���Ӧˮ�ⷴӦ�����´���ѡ�����½�����C��ȷ��
D���¶ȸ���65��ʱ����������ֽ⣬���������ᷢ����ˮ�ⷴӦ���������ڷ�Ӧ���У���D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʣ�
��A��B��C��D��E����ԭ���������������Ԫ�أ�ԭ��������С��30����A�Ļ�̬ԭ��2p�ܼ���3�������ӣ�C�Ļ�̬ԭ��2p�ܼ���1�������ӣ�Eԭ���������1�������ӣ���������3���ܼ��Ҿ��������ӣ�D��Eͬ���ڣ��۵�����Ϊ2����
��1��BԪ�ص��⻯��ķе���ͬ��Ԫ���⻯������ߵģ�ԭ����__________________��
��2��A��B��C ����Ԫ�ص��⻯���ȶ�����ǿ������˳��Ϊ_________(�û�ѧʽ��ʾ)��
��3��A������⻯����ӵĿռ乹��Ϊ_______������Aԭ�ӵ��ӻ�������________��
��4��A�ĵ����������ĸ���Ϊ_______________�������ĸ���Ϊ_______________��
��5��д����̬Eԭ�ӵļ۵����Ų�ʽ��__________________________��
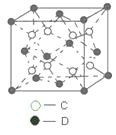
��6��C��D�γɵĻ�����ľ����ṹ��ͼ��ʾ����֪������ܶ�Ϊ��g��cm��3�������ӵ�����ΪNA�����߳�a ��________cm��(������NA�ļ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���е��к�������Ҫ��NO��̼�⻯���PCO��ijУͬѧ���ʵ�齫ģ������β��ת��Ϊ�����塣�ش��������⣻
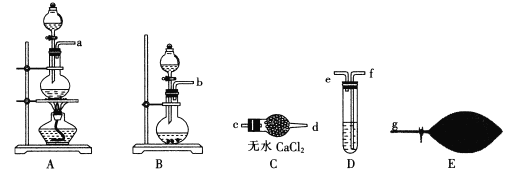
(1)Ϊ������ģ��β��������ͬѧ����ͼ��ʾװ�÷ֱ��Ʊ�NO����ϩ��CO�������塣
����װ��A��ȡNO����Һ©����ʢ�ŵ���___(���Լ�����)��
����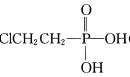 (��ϩ��)��NaOH��Һ����װ��B��ȡ��ϩ����Ӧ������ϩ�Ļ�ѧ����ʽΪ______(��ת��ΪNa3 PO4)��
(��ϩ��)��NaOH��Һ����װ��B��ȡ��ϩ����Ӧ������ϩ�Ļ�ѧ����ʽΪ______(��ת��ΪNa3 PO4)��
����H2 C2 O4��Ũ������ȡCO(��ѧ����ʽΪH2C2O4 ![]() CO+CO2+H2O���ᴿ��ѡ����ͼװ��Ԥ��һ�����﴿����CO�����ӿ����ӵ�˳��Ϊ___��g(������������)������װ��D��ʢ�ŵ�ҩƷ��___
CO+CO2+H2O���ᴿ��ѡ����ͼװ��Ԥ��һ�����﴿����CO�����ӿ����ӵ�˳��Ϊ___��g(������������)������װ��D��ʢ�ŵ�ҩƷ��___
(2)����ͬѧ�������Ƶõ�������������ʵ���������γ�ģ��β��(NO��CO��C2 H4������)������ͼ��ʾ װ�ý���β��ת�������顣
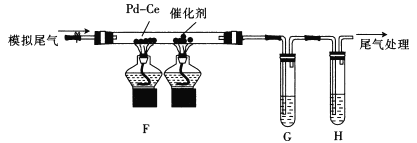
��Ϊ�������Ӧ����������Ƿ���CO2���ɺ���ϩ�IJ�����G��H��ʢ�ŵ��Լ�������_________(����)��
a. NaOH��Һ��b.����KMnO4��Һ
c.����ʯ��ˮ��d. Br2��CCl4��Һ
��ͨ��ģ��β����ǰ�����Ƚ��������ȵ���Ӧ������¶ȣ���Ŀ����___��д������CO��NO��ȫת��Ϊ������Ļ�ѧ����ʽ��___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����120�桢1.01��105Paʱ����3LȲ���������Ļ����������ͬ״���µ�14LO2��ϣ����ȼ�պָ���ԭ��״̬ʱ����������������17L����û��������������и����еģ� ��
A.C2H4��C2H6B.C3H4��CH4C.C2H2��CH4D.C4H6��C2H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�ؼ��仯�����ڹ�ũҵ���������������ж�������Ҫ��Ӧ�á�
��1���������岻��ȱ����Ԫ�أ�Ϊ�˷�ֹ��ȱ���������г�������һ�ּӵ��Σ������ھ���������һ������KIO3��ȥ��ij�о�С��Ϊ�˼��ij�ӵ������Ƿ��е⣬�������йص����ϣ���������ԭ���ǣ�KIO3+5KI+3H2SO4��3I2+3H2O+3K2SO4
���������뻹ԭ�������ʵ�������_______�������Ӧ����0.3mol�ĵ��ʵ⣬��ת�Ƶĵ�����Ŀ��_______��
����ȡ�����ļӵ��μ�����ˮ�ܽ⣬Ȼ�����ϡ�����KI��Һ��������һ������CCl4������ʱ�۲쵽��������_____��
����������ͼʵ��װ�ý����Ȼ�̼��I2�Ļ����Һ���롣
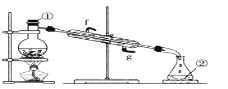
д��ͼ�����������ƣ���_____����װ�û�ȱ�ٵ�������_____�������ܵĽ�ˮ���ǣ�_____����g��f����
��2��ʵ���ҳ���MnO2��Ũ��������������Ӧԭ����MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��ʵ������MnO2��Ũ���������������ӷ���ʽ��__________________________
��������Ӧ����������__________����ԭ����__________����������HCl��δ��������HCl�ı�ֵ______________��
��a : Cl2+2I-=I2+2Cl-�� b: Cl2+2Fe2+=2Fe3++Cl-�� c:2Fe3++2I-=I2+2Fe2+�� Cl2��I2��Fe3+����������ǿ������˳��_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ���ǣ� ��
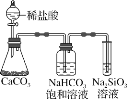
A.��̬�⻯����ȶ��ԣ�HCl��CH4��SiH4
B.��Ԫ������һ�ַǽ���Ԫ���γɵĻ�����һ���ǹ��ۻ�����
C.��ͼ��ʾʵ�鲻��֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D.�������� ![]() ������o�������ĵ� 118 ��Ԫ�������ڱ���λ�ڵ������� 0 ��
������o�������ĵ� 118 ��Ԫ�������ڱ���λ�ڵ������� 0 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00mL0.1mol/L�ļװ�(CH3NH2)��Һ�еμ�0.1mol/L �����ᣬ�����Һ��pH�������Ũ�ȱ�ֵ�Ķ�����ϵ��ͼ��ʾ������˵������ȷ����( )
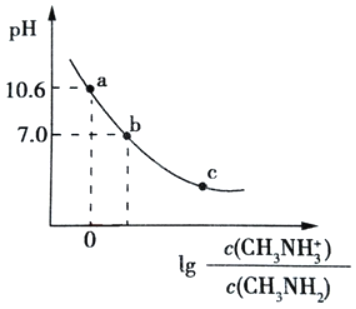
A.��֪�װ��ļ�����ǿ�ڰ����װ���ˮ�еĵ��뷽��ʽΪCH3NH3++H2OCH3NH2+OH��
B.b�������������V��20.00 mL
C.�������ʵ�����CH3NH2��CH3NH3Cl ��������ˮ���ɵõ� a ���Ӧ����Һ
D.�����£��װ��ĵ��볣��Ϊ Kb���� pKb��-lgKb��3.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��.�����£�����c(H+) ��ͬ�Ĵ���������ң�
(1)��ͬ�����£�ȡ������ļ�������Һ����ϡ��100����ϡ�ͺ����Һ����c(H+) ��С��ϵΪ��
�� _____________�� (������������С������������������ͬ)��
(2)��ȡ25 mL�ļ�������Һ���ֱ����Ũ�ȵ�NaOHϡ��Һ��ȫ��Ӧ�������ĵ�NaOH��Һ�������С��ϵΪV(��) _____________ V(��)��
��.��֪25 ��ʱ�й�����ĵ���ƽ�ⳣ�����£�
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | Ka1=4.3��10-7 Ka2=5.6��10-11 |
(1)25 ��ʱ����20 mL 0.1 mol��L-1 CH3COOH��Һ��20 mL 0.1 mol��L-1 HSCN��Һ�ֱ���20 mL 0.1 mol��L-1 NaHCO3��Һ��ϣ�ʵ���ò������������(V)��ʱ��(t)�ı仯��ͼ��ʾ��
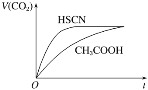
��Ӧ��ʼ��������Һ����CO2��������ʴ������Բ����ԭ���� _____________��
(2)�������¶Ȳ��䣬�ڴ�����Һ��ͨ��һ�������������и������С���� ______________(����ĸ)��
a.c(CH3COO-) b.c(H+) c.Kw d.�������ƽ�ⳣ��
III.(1)HClO4H2SO4HCl��HNO3����ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣��������˵������ȷ���� _________��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10-5 | Ka1��6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
A.�¶Ȼ�Ӱ�����������ڱ����еĵ��볣��
B.�ڱ�������HClO4��������������ǿ����
C.�ڱ�������H2SO4�ĵ��뷽��ʽΪH2SO4===2H++SO42-
D.���������ڱ������ж�û����ȫ���룬��������ǿ�����
(2)�������Ƕ�Ԫ��ǿ�ᣬ25 ��ʱ������(H3PO3)�ĵ��볣��ΪK1=1��10-2K2=2.6��10-7��
���Դӵ���ƽ���ƶ��ĽǶȽ���K1Ϊʲô��K2��_______________________ ��
��д��������ĵ��뷽��ʽ(2��)_________________��_______________ ��
�������һ�ַ�����ʹ֮��ͨ��ֱ�۵�ʵ�������жϴ��������ǿ��H2S���÷������õ��Լ��� __________����Ӧ�Ļ�ѧ����ʽΪ _____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������(CH3OCOOCH3�����DMC)��һ��Ӧ��ǰ���㷺���²��ϡ����ܱ������а�n(CH3OH):n(CO2)=2:1Ͷ��ֱ�Ӻϳ�DMC����Ӧ����ʽΪ��2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)��һ�������£�ƽ��ʱCO2��ת������ͼ��ʾ������˵���в���ȷ����( )
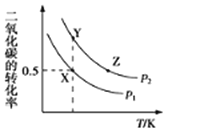
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.ѹǿ![]()
C.X���Ӧ��ƽ�ⳣ��Ϊ![]()
D.X��Y��Z�����Ӧ�ij�ʼ��Ӧ���ʵĹ�ϵΪZ>Y>X
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com