
| A. | H3O+和OH- | B. | CH3+和NH4+ | C. | NO3-和NO2- | D. | SO42-和PO43- |
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
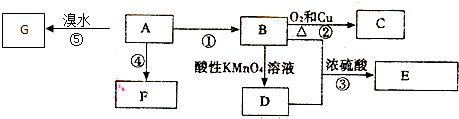
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应过程转移0.2mol电子,则生成0.1mol羰基硫 | |
| B. | CO和H2S的反应中,H2S作还原剂 | |
| C. | 羰基硫的化学式为COS,是一种共价化合物 | |
| D. | 1mol羰基硫完全燃烧,消耗1.5mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
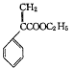 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 1mol颠茄酸酯最多与4molBr2发生加成反应 | |
| C. | 能与NaHCO3溶液反应 | |
| D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
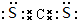 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) | ||
| C. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | D. | c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
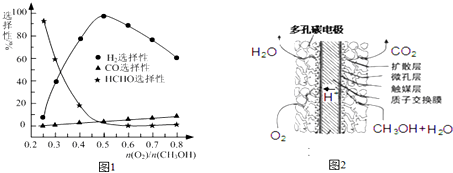
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com