
一定条件下硝酸铵受热分解的未配平化学方程式为 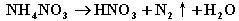 ,在反应中被氧化与被还原的氮原子之比为( )
,在反应中被氧化与被还原的氮原子之比为( )
A.1∶1 B.5∶4 C.5∶3 D.3∶5
科目:高中化学 来源: 题型:
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
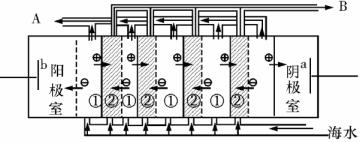
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有
ⅱ上图中虚线部分表示 离子交换膜。 淡水从 (A或B) 排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
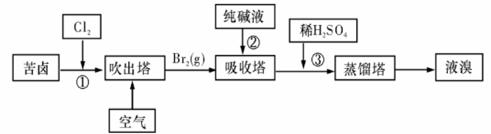
ⅰ写出反应③的离子方程式为: 。
ⅱ通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?
ⅲ向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各溶液的叙述中正确的是
A. NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B. 0.1 mol/L 的醋酸钠溶液20 mL与0.1 mol/L盐酸10mL 混合后溶液显酸性:
c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:
c(Na+)=c(SO42-) >c ( NH4+)> c(H+)>c(OH-)
D. 向1.00L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:
c(Na+)>c(CO32-) >c(HCO3-)>c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物,一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下:
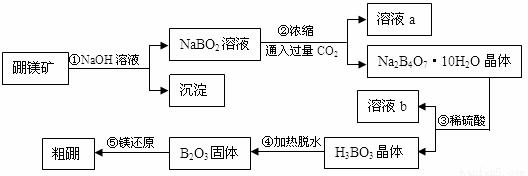
回答下列问题:
(1)Mg2B2O5·H2O中B的化合价为_____________。
(2)溶液a、溶液b中溶质的化学式分别为_________、_________。
(3)写出步骤①的化学方程式_______________________________。
(4)写出步骤⑤的化学方程式_______________________________。
(5)步骤③中化学反应可以发生的原因是______________________。
(6)BF3是有机化学中常用的酸性催化剂,BF3分子中B和F最外层的电子数分别为_____、______个。
(7)乙硼烷(B2H6)是一种气态高能燃料,写出乙硼烷在空 气中燃烧的化学方程式____ 。
气中燃烧的化学方程式____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
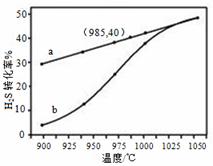 利用H2S废气制取氢气来的方法有多种
利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)  H2(g)+
H2(g)+ 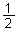 S2(g)
S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=___ ___;说明随温度的升高,曲线b向曲线a逼近的原因:
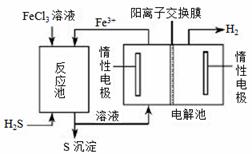 ②电化学法
②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 。反应后的溶液进入电解池,电解总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平氧化还原反应方程式:
____C2O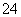 +____MnO
+____MnO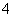 +____H+===____CO2↑+____Mn2++____H2O
+____H+===____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是 ( )
①含氧酸能起氧化作用,无氧酸则不能 ②阳离子只有氧化性,阴离子只有还原性
③失电子难的原子获得电子的能力一定强 ④由X变为X2+的反应是氧化反应
⑤化学反应中,若某元素从化合物中游离出来,则该元素可能被还原,也可能被氧化
⑥发生化学反应时失去电子越多的金属原子,还原能力越强
⑦金属阳离子被还原后,一定得到该元素的单质
A.①②⑦ B.③④⑥ C.④⑤⑦ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
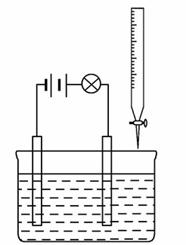
A.盐酸逐滴加入到食盐溶液中
B.硫酸逐滴加入到氢氧化钠溶液中
C.硫酸逐滴加入到氢氧化钡溶液中
D.醋酸逐滴加入到氨水(醋酸、氨水均为弱电解质,两者生成的CH3COONH4为强电解质)中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com