
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
分析 A.常温下浓硫酸能使铝表面形成致密氧化膜,发生钝化;
B.二氧化硅与氢氟酸反应生成四氟化硅和水;
C.氯气与水反应生成HClO,次氯酸具有强氧化性;
D.液氨汽化时要吸收大量的热.
解答 解:A.浓硫酸具有强氧化性,能与金属发生氧化还原反应,常温下浓硫酸能使铝表面形成致密氧化膜,发生钝化,阻止反应进一步发生,可在常温下用铝制贮藏贮运浓硫酸,故A正确;
B.石英的主要成分是二氧化硅,二氧化硅可与氢氟酸反应生成四氟化硅气体和水,所以不能用石英器皿盛放氢氟酸,故B错误;
C.氯气与水反应生成HClO,次氯酸具有强氧化性,能杀菌消毒,所以氯气可用于自来水的杀菌消毒,故C正确;
D.液氨汽化时要吸收大量的热,使周围环境的温度降低,所以液氨可用作制冷剂,故D正确.
故选B.
点评 本题考查物质的性质和用途,题目难度不大,明确有关物质的性质及用途是解决本题的关键,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
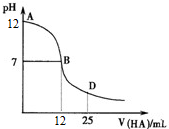
| A. | MOH在水中的电离方程式是MOH═M++OH- | |
| B. | 在B点表示酸碱恰好中和 | |
| C. | 随着盐酸的加入,溶液的导电能力逐渐增强(忽略体积变化) | |
| D. | 在D点时,存在c(OH-)>c(Na+)>c(Cl-)>c(M+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3受热易分解,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3熔点高,可用作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子结构示意图: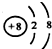 可以表示16O2-,也可以表示18O2- 可以表示16O2-,也可以表示18O2- | |
| B. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 氯化铵的电子式为: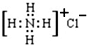 | |
| D. | 二氧化碳分子的比例模型是: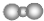 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
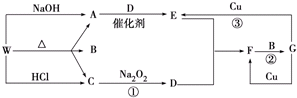
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com