
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
【答案】Pb-2e-+SO42-=PbSO4 6.4 MgO(或Mg(OH)2、MgCO3等) 4×10-8 mol·L-1 1.2×10-4 Cu2+ 6.5
【解析】
(1)根据电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O可知,放电时,Pb作负极,PbO2作正极,负极的电极反应式为:Pb-2e-+SO42-=PbSO4,充电时,原负极板发生反应为:PbSO4+2e-=Pb+SO42-,原正极板发生反应为:PbSO4-2e-+2H2O=PbO2+SO42-+4H+,电路通过0.2mol电子时,理论上正极板的质量减少6.4g;
2PbSO4+2H2O可知,放电时,Pb作负极,PbO2作正极,负极的电极反应式为:Pb-2e-+SO42-=PbSO4,充电时,原负极板发生反应为:PbSO4+2e-=Pb+SO42-,原正极板发生反应为:PbSO4-2e-+2H2O=PbO2+SO42-+4H+,电路通过0.2mol电子时,理论上正极板的质量减少6.4g;
故答案为:Pb-2e-+SO42-=PbSO4 ;6.4;
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①为得到纯净的MgCl2·2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为MgCl2,所以应该加入含Mg元素的物质,可以是MgO(或Mg(OH)2、MgCO3等),调节溶液的pH=4,溶液中c(H+)=10-4 mol·L-1, c(OH-)=10-10 mol·L-1,使溶液中的Fe3+转化为Fe(OH)3沉淀,c(Fe3+)=![]() mol·L-1;故答案为:MgO(或Mg(OH)2、MgCO3等);
mol·L-1;故答案为:MgO(或Mg(OH)2、MgCO3等);![]() ;
;
②等体积混合浓度减半,c(Mg2+)=0.005 mol·L-1,![]() =1.8×10-11,c(OH-)=6×10-5,所以NaOH溶液的浓度为6×2×10-4=1.2×10-4mol·L-1;
=1.8×10-11,c(OH-)=6×10-5,所以NaOH溶液的浓度为6×2×10-4=1.2×10-4mol·L-1;
故答案为:1.2×10-4;
(3)pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀, 0.3mol/L的CuSO4溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加NaOH溶液,c(Cu2+)=10-5mol/L,c(OH-)=![]() =10-7.5mol/L,c(H+)=10-6.5mol/L,所以pH=6.5,
=10-7.5mol/L,c(H+)=10-6.5mol/L,所以pH=6.5,
故答案为Cu2+;6.5。


科目:高中化学 来源: 题型:
【题目】如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
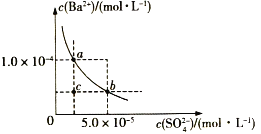
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示.下列说法正确的是
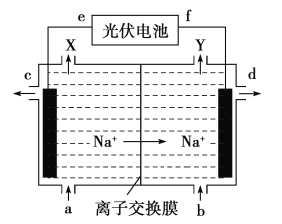
A. 上述装置中,f极为光伏电池的正极
B. 阴极的电极反应为2H2O-4e- =4H++O2↑
C. d处得到较浓的NaOH 溶液,c处得到HClO4
D. 若转移2mol电子,理论上生成100.5gHClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是( )
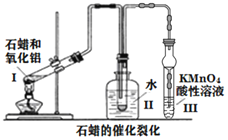
A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
D.酸性KMnO4溶液若倒吸可加快褪色速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯的发生装置如图所示。下列说法正确的是

A.烧瓶中加入乙醇、浓硫酸和碎瓷片
B.反应温度控制在140℃
C.导出的气体中只有乙烯
D.可用向上排气法收集乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__。阳离子[H2F]+的空间构型为__,写出[H2F]+的等电子体__(分子和离子各举一例)。
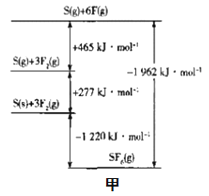
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___kJmol-1。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20gmol-1的数据,原因是__。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__(填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__(用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__。
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__(填具体的微粒符号)。
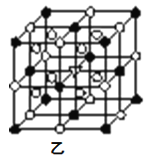
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
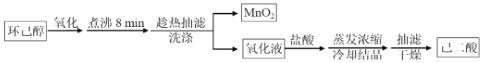
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
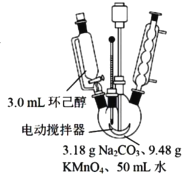
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )

A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com