
| A. | 5:3:2 | B. | 5:2:3 | C. | 5:1:2 | D. | 9:6:1 |
分析 相对分子质量为70的Cl2分子是由两个35Cl原子构成,相对分子质量为72的Cl2分子是由一个35Cl原子和一个37Cl构成,相对分子质量为74的Cl2分子是由两个37Cl原子构成.先设出相对分子质量为70、72、74的Cl2分子个数分别为X、Y、Z个,可知35Cl原子有(2X+Y)个,37Cl原子有(Y+2Z) 个,所以(2X+Y):(Y+2Z)=3:1,可解得X=Y+3Z,然后采用逐一验证法来确定答案.
解答 解:设相对分子质量为70、72、74的Cl2分子个数分别为X、Y、Z个,
相对分子质量为70的Cl2 是由 2个35Cl组成的,故x个相对分子质量为70的Cl2 中含有的35Cl原子个数为 2X 个;
相对分子质量为72的Cl2是由一个35Cl和一个37Cl组成,故y个相对分子质量为72的Cl2 中含有的35Cl原子和37Cl原子个数分别为为Y个;
相对分子质量为74的Cl2是由 2个37Cl组成的,故z个相对分子质量为74的Cl2 中含有的37Cl原子个数为为2Z个;
通过上述分析可知则:35Cl原子有(2X+Y)个,37Cl原子有 (Y+2Z) 个,
∵35Cl和37Cl个数之比为 3:1,
则(2X+Y):(Y+2Z)=3:1,
即 3Y+6Z=2X+Y,
解得 X=Y+3Z,
满足此关系就可,
A.将X=5、Y=3、Z=2分别带入关系式X=Y+3Z,可知不成立,故A错误;
B.将X=5、Y=2、Z=3分别带入关系式X═Y+3Z,可知不成立,故B错误;
C.将X=5、Y=1、Z=2分别带入关系式X═Y+3Z,可知不成立,故C错误;
D.将X=9、Y=6、Z=1分别带入关系式X═Y+3Z,可知成立,故D正确.
故选D.
点评 本题以同位素为依托考查物质的量计算,把握原子个数的相关分析和计算为解答的关键,侧重分析能力和计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
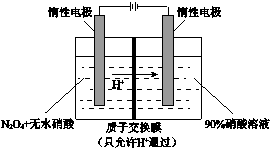 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
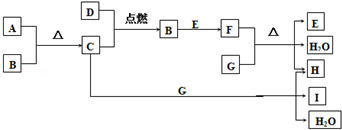
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题: (填电子式),B
(填电子式),B (填结构式),E
(填结构式),E (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“APEC蓝” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③④ | B. | 仅②③④ | C. | 仅①③⑤ | D. | 仅②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
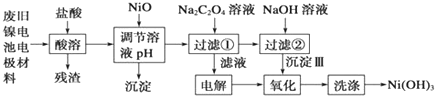
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com