
| A. | 6.72 L | B. | 8.98 L | C. | 11.56 L | D. | 13.44 L |
分析 铁粉由于表面积很大,和浓硝酸剧烈反应,放出热量很多,促进氧化膜在较高温度下与浓硝酸反应,故铁粉能与浓硝酸反应,由于铁粉足量,反应生成Fe(NO3)2,开始生成NO2,随反应进行,变为稀硝酸时会生成NO,假设气体全部为NO2,或者全部为NO,结合Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,计算确定所得气体的体积范围.
解答 解:铁粉由于表面积很大,和浓硝酸剧烈反应,放出热量很多,促进氧化膜在较高温度下与浓硝酸反应,故铁粉能与浓硝酸反应,由于铁粉足量,反应生成Fe(NO3)2,开始生成NO2,随反应进行,变为稀硝酸时会生成NO,HNO3的物质的量为0.1L×12mol/L=1.2mol,
假设气体全部为NO2,则:
Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O
4 2
1.2mol x
x=$\frac{1.2mol×2}{4}$=0.6mol,
故V(NO2)=0.6mol×22.4L/mol=13.44L,
假设全部全部为NO,则:
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
8 2
1.2mol y
所以y=$\frac{1.2mol×2}{8}$=0.3mol
故V(NO)=0.3mol×22.4L/mol=6.72L
故所得气体的体积介于6.72L~13.44L之间,
故选:BC.
点评 本题考查化学方程式计算,关键是极端法中极值点确定,注意铁粉与浓硝酸难以发生钝化现象,属于易错题目.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
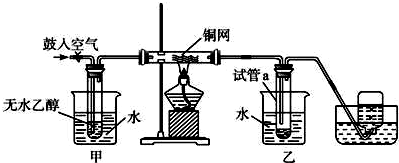
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
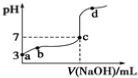
| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SO32-的中心原子均为sp3杂化 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | 分子晶体的堆积均采取分子密堆积 | |
| D. | CS2为V形的极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
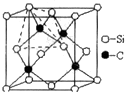 碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:
碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
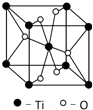 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如图所示某有机物,根据该有机物的结构回答:
有如图所示某有机物,根据该有机物的结构回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com