
下列说法正确的是
A. FeSO4溶液存放在加有少量铁粉的试剂瓶中
B. 将1mol/L的NaCl溶液保存在容量瓶中
C. 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂
D. 用pH试纸检验某溶液的酸碱性时,一定要先用蒸馏水湿润
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组化合物中,化学键的类型完全相同的是
①CaCl2 和Na2S ②Na2O 和 Na2O2 ③CO2和 CS2 ④HCl 和 NaOH
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:简答题
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=_____kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______。
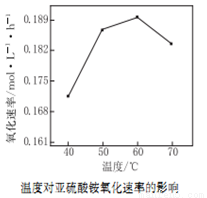
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=____。 [已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6 ]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:选择题
下列有关物质的性质和用途的描述均正确的是( )
A. 二氧化锰具有强氧化性.能将双氧水氧化为氧气
B. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
C. 炭具有还原性,可用炭在高温下将二氧化硅还原为硅
D. .汽油是常见的有机溶剂,可以用裂化汽油来萃取漠水中的溴
查看答案和解析>>
科目:高中化学 来源:天津市红桥区2017届高三一模化学试卷 题型:选择题
通过膜电池可除去废水中的乙酸钠和对氯笨酚( ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为: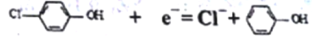
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:选择题
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。根据实验现象得出的结论中,正确的是( )
A. 待测液中一定存在Ba2+、Fe3+ B. 待测液中一定存在Ag+、Fe3+、NH4+
C. 待测液中一定不存在Ba2+ D. 待测液中无法确定的离子可用焰色反应检验
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:选择题
下列离子方程式中书写正确的是( )
A. 向FeCl2溶液中通入Cl2:Fe2+ + Cl2 = Fe3+ + 2Cl―
B. Ba(OH)2溶液与硫酸的反应:OH―+ H+ = H2O
C. 碳酸氢钠溶液与稀盐酸混合:HCO3―+ H+ = H2O+CO2↑
D. AlCl3溶液中加入过量氨水:Al3+ + 4OH― = AlO2― + 2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:填空题
(1)工业上可在碱性溶液中通过电解的方法实现由N2制取NH3:
2N2+6H2O 4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
(2)有人设想寻求合适的催化剂和电极材料.以N2,H2为电极反应物;以HCl-NH4Cl为电解质榕液制取新型燃料电池。请写出该电池的正极反应式________________。
(3)电解原理在化学工业中有着广泛的应用。若用惰性电极电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体672mL(标准状况下)时,溶液的c(H+)=_____(假设电解后溶液体积不变)。
(4)铁、铝是现代金属材料的主角。
已知铝的燃烧热为1675kJ/mol,2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-822kJ/mol;
则2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H=________;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二开学质检(3月)化学试卷(解析版) 题型:简答题
(Ⅰ)(1)在25℃、101kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。则甲醇的燃烧热的热化学方程式为:_________________________________
(Ⅱ)现用中和滴定测定某盐酸溶液的浓度,有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗烧碱标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.12 | 24.62 |
2 | 25.00 | / | / | / |
3 | 25.00 | 5.00 | 29.58 | 24.58 |
(2)实验中有石蕊和酚酞两种指示剂,该实验应选用_______作指示剂。用______式滴定管盛装0.2500 mol/L烧碱标准液,锥形瓶中装有25.00mL待测盐酸溶液。
(3)下图表示第二次滴定时50 mL滴定管中前后液面的位置。该次滴定所用标准烧碱溶液体积为_______mL。
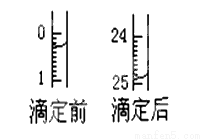
(4)根据所给数据,计算出该盐酸的物质的量浓度(注意保留合适的有效数字),c (HCl) = _____________ 。
(5)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________。(填“无影响”、“偏高”、“偏低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com