
|
元素气态原子失去一个电子,使之成为+1价阳离子所需提供的能量叫做元素的第一电离能.根据元素周期律,下列元素的第一电离能最大的是 | |
| [ ] | |
A. |
S |
B. |
Na |
C. |
P |
D. |
Cl |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
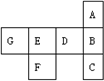 (2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.
(2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.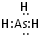
查看答案和解析>>
科目:高中化学 来源: 题型:
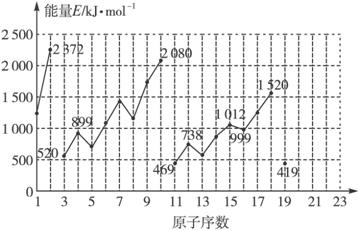
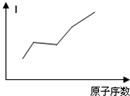
试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
(1)同主族内不同元素的E值变化的特点是____________________________,各主族中的E值的这种变化特点体现了元素性质的________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系中正确的是________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________。
(4)10号元素E值较大的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示,试根据元素在周期表中的位置,分析图中曲线的变化特点.并回答下列问题。?
1至19号元素气态原子失去最外层一个电子所需能量:?

⑴同主族内不同元素的E值变化的特点是:________________。各主族中E值的这种变化特点体现了元素性质的________________________变化规律。
⑵同周期内,随原子序数增大,E值增大,但个别元素的E值出现反常现象,试预测下列关系式中正确的是_________________________(填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)?
③E(溴)>E(硒) ④E(溴)<E(硒)??
⑶估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________。
⑷10号元素E值较大的原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com