
 .(不考虑空间构型)
.(不考虑空间构型) 分析 (1)①Cu是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式;
②碳酸根离子中C原子价层电子对个数=3+$\frac{4+2-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型;
(2)①原子个数相等、价电子数相等的微粒互为等电子体,与CO互为等电子体的微粒中含有2个原子且价电子数为10;
②甲醛分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式;
③二氧化碳的结构式为O=C=O,每个二氧化碳分子中含有2个σ键;
(3)[Cu(OH)4]2-中Cu原子和氢氧根离子之间存在配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,该微粒中Cu原子含有空轨道、O原子含有孤电子对.
解答 解:(1)①Cu是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,故答案为:1s22s22p63s23p63d9或[Ar]3d9;
②碳酸根离子中C原子价层电子对个数=3+$\frac{4+2-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型为平面正三角形,故答案为:平面正三角形;
(2)①原子个数相等、价电子数相等的微粒互为等电子体,与CO互为等电子体的微粒中含有2个原子且价电子数为10,所以与CO互为等电子体的离子有CN-(或NO+),故答案为:CN-(或NO+);
②甲醛分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2 ,
故答案为:sp2 ;
③二氧化碳的结构式为O=C=O,每个二氧化碳分子中含有2个σ键,则1mol CO2中含有的σ键数目为2mol或2×6.02×1023或2NA,
故答案为:2mol或2×6.02×1023或2NA;
(3)[Cu(OH)4]2-中Cu原子和氢氧根离子之间存在配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,该微粒中Cu原子含有空轨道、O原子含有孤电子对,所以[Cu(OH)4]2-的结构可用示意图表示为 ,
,
故答案为: ;
;
点评 本题考查物质结构和性质,为高频考点,涉及原子核外电子排布式的书写、微粒空间构型判断、等电子体、原子杂化方式判断、配位键等知识点,明确原子或物质结构、基本概念是解本题关键,难点是判断微粒空间构型及原子杂化方式判断.


科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a>b+1 | |
| C. | pH=9的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>③>② | |
| D. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下60gSiO2与足量纯碱反应,最多释放出2NA个气体分子 | |
| B. | 1molC5H12分子中共价键总数为14NA | |
| C. | 78gNa2O2固体与足量的H2O反应转移的电子数为NA | |
| D. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用焰色反应鉴別Na2CO3溶液和K2CO3溶液 | |
| B. | 用分液漏斗分离食醋中的乙酸与水 | |
| C. | 用丁达尔现象检验NaCl溶液中是否含有淀粉胶体 | |
| D. | 用NaOH溶液除去Cl2中混有的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. | 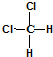 和 和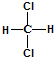 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| D. | 锌铜原电池中,锌做负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①③④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| C. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com