
| A. | 0.5mol | B. | 0.55mol | C. | 1mol | D. | 2mol |
分析 将20g A、20g B及20g C混合,完全反应后,得9g B,24.5g C,则20gA完全反应,参加反应的B的质量为:20g-9g=11g,生成的C的质量为:24.5g-20g=4.5g,根据质量守恒定律计算生成的D的质量,根据质量守恒定律,判断44g A和44g B反应,哪种物质有剩余,根据不足量的物质利用质量定比关系计算生成D的质量,再根据n=$\frac{m}{M}$计算生成的D的物质的量.
解答 解:将20g A、20g B及20g C混合,完全反应后,得9g B,24.5g C,则20gA完全反应,参加反应的B的质量为:20g-9g=11g,生成的C的质量为:24.5g-20g=4.5g,
根据质量守恒定律可知,生成的D的质量为:60g-9g-24.5g=26.5g,
44gB完全反应需要A的质量为:20g×$\frac{44g}{11g}$=80g,大于44g,则44g A和44g B反应时,A不足会完全反应,反应生成D的质量为:26.5g×$\frac{44}{20}$=58.3g,
故生成D的物质的量为:$\frac{58.3g}{106g/mol}$=0.55mol,
故选B.
点评 本题考查化学方程式的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题有利于提高学生的分析能力及化学计算能力.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:
某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
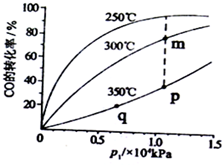 通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.
通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO(g) | H2 | CO(g) | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 1.5 | 2 |
| 3 | 2 | 4 | 1.0 | n | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com