
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol
N2O5,达到平衡时,气体的压强为原来的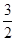 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
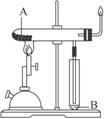
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。

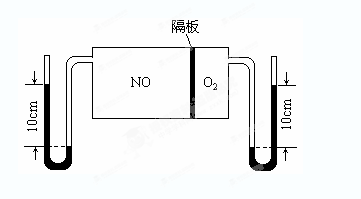
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。
(1)①不变;②0.00296 mol· L-1· s-1;③1/3;2/27;(2)阳极;N2O4 - 2e- + 2HNO3= 2N2O5 + 2H+;
(3)42.9
【解析】
试题分析:(1)①一定温度下,在恒容密闭容器中,反应达到平衡后,若再通入一定量氩气,反应混合气的浓度不变,反应速率不变,平衡不移动,则N2O5的转化率不变;②根据v=△c/△t,将题给数据代入计算,500s内N2O5的分解速率为0.00296mol· L-1· s-1;③等温等容的条件下,压强之比等于气体的物质的量之比,根据三行式进行计算,设转化的O2的浓度为x
2N2O5(g)
 4NO2(g)+O2(g)
4NO2(g)+O2(g)
起始浓度(mol/L) 1 0 0
转化浓度(mol/L) 2x 4x x
平衡浓度(mol/L)(1-2x) 4x x
依题意得,(1+3x)/1=3/2, x=1/6;N2O5的转化率a1=1/3;将题给数据代入平衡常数表达式
K=c(O2) c4(NO2)/ c2(N2O5)计算得K=2/27;
(2)根据题给装置可知,是利用N2O4来制备N2O5,氮元素的化合价由+4价升高到+5价,发生氧化反应,则N2O5在电解池的阳极区生成,其电极反应式为:N2O4 - 2e- + 2HNO3= 2N2O5 + 2H+;
(3)设反应前NO为3mol,O2为1mol,混合气的总物质的量为4mol,总质量为122g, 根据阿伏伽德罗定律知,等温等容的条件,压强之比等于气体的物质的量之比,结合题给信息,n平/n始=7.1/10;
n平=2.84mol,M平=122g/2.84mol=42.9g/mol,相对分子质量为42.9.
考点:考查化学反应速率与化学平衡的计算、电解原理及阿伏伽德罗定律。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
 (1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.
(1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年江苏省启东中学高一第二学期期中考试化学(实验班)试题 题型:填空题
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com