
【题目】25℃时在10mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( ) 
A.Na2CO3溶液中c(Na+)═2[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)]
B.a、b曲线分别代表的是HCO3﹣、H2CO3量的变化情况
C.A点时:c(Na+)>c(CO32﹣)═c(HCO3﹣)>c(H+)>c(OH﹣)
D.B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3
【答案】C
【解析】解:A.Na2CO3溶液中存在物料守恒,即Na元素的总物质的量等于C元素总物质的量的2倍,则c(Na+)═2[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)],故A正确; B.Na2CO3溶液中逐滴加入HCl先发生反应CO32﹣+H+=HCO3﹣ , 然后发生HCO3﹣+H+=H2CO3 , 由图象可知a代表的物质逐渐增多,则aHCO3﹣ , b代表的物质开始没有,后来逐渐增多,则b为H2CO3 , 故B正确;
C.由图象可知,A点时:c(CO32﹣)和c(HCO3﹣)相同,溶液显碱性,则c(Na+)>c(CO32﹣)═c(HCO3﹣)>c(OH﹣)>c(H+),故C错误;
D.B点时加入盐酸的体积为10mL,则Na2CO3和HCl的物质的量相同,由CO32﹣+H+=HCO3﹣可知,二者恰好反应生成NaHCO3 , 故D正确.
故选C.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是_____________;电解质溶液Y是_______________。
(2)银电极为电池的______极,发生的电极反应式为_______________________;X电极上发生的电极反应为_______________________________________。
(3)盐桥中______(选填“阳离子”或“阴离子”)向硫酸铜溶液方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)的原子序数是5,硼的最高价氧化物的水化物的化学式不可能是( )
A. HBO2 B. H3BO3 C. H2BO3 D. H4B2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是______(答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH2,总反应为:xNi(OH)2+M![]() xNiOOH+MHx,试写出放电过程中负极反应式______。
xNiOOH+MHx,试写出放电过程中负极反应式______。
(3)施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O == BO2-+4H2↑,已知NaBH4与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为______,用离子方程式表示溶液显碱性的原因______。
(4)在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入a g的储氢合金(M)和b mol H2发生如下反应:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0。三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如下图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______。当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是____。
2MHx(s) ΔH<0。三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如下图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______。当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是____。
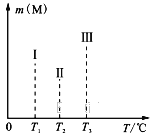
(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢:![]() 。维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=_____(用α等符号表示)。
。维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=_____(用α等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环上原有的取代基对新导入苯环上的取代基的位置有一定影响,其规律是:①苯环上新导入的取代基所占的位置主要决定于原有取代基的性质。②可以把原有取代基分成两类:第一类取代基主要使新导入的取代基进入苯环的邻位和对位,如—OH、—Cl、—Br、-O-COR等;第二类取代基主要使新导入的取代基进入苯环的间位,如—NO2、—SO3H、—CHO、—COOH等。
分析下列变化:
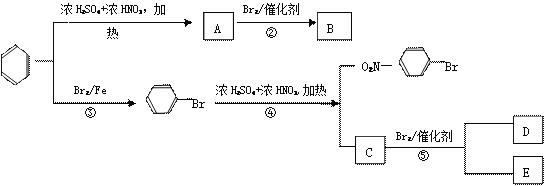
(1)A中官能团的名称是____________,C的结构简式_____________;
(2)B、C与![]() 互为同分异构体,D、E为同分异构体,则D、E的结构简式分别为:
互为同分异构体,D、E为同分异构体,则D、E的结构简式分别为:
_______________、_________________;
(3)写出上图中第④步生成C的化学方程式________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm—3 | 0.88 | 3.10 | 1.50 |
沸点℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)写出a中生成溴苯的化学方程式 ;
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了__________气体,继续滴加至液溴滴完。装置d装置的作用是 。
(3)液溴滴完后,经过下列步骤分离提纯: ①向a中加入10 mL水,然后过滤除去未反应的铁屑; ②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是 ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为__ ;要进一步提纯,下列操作中必须的是______(填入正确选项前的字母)。
A. 重结晶 B. 过滤 C. 萃取 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是周期表中的一部分,根据A﹣K在周期表中的位置,用元素符号或化学式回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H | ||||
4 | J | K |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的 ,
(4)在这些元素中(除I外),原子半径最大的是 , 原子半径最小的是
(5)D和K组成化合物的电子式 ,
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com