
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是

A. 图甲表示有无催化剂的反应,加催化剂可以改变反应的焓变
B. 图乙表示等浓度等体积的NaCl、NaBr及NaI溶液分别用AgNO3溶液滴定曲线,a为Cl-
C. 图丙表示等浓度等体积的盐酸和醋酸分别用NaOH溶液的滴定曲线,指示剂都可用酚酞
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
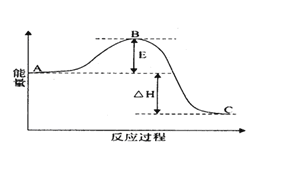
已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJmol-1.请回答下列问题:
(1)E的大小对该反应的反应热______(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”还是“降低”)。
(2)完成SO2氧化为SO3的热化学方程式______________________。
(II)用 50mL0.50mol/L 盐酸与 50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
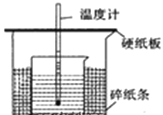
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。实验中能否用环形铜丝搅拌棒代替该用品_______(填“能”或“否”)
(2)向盐酸溶液中加入NaOH溶液的正确操作是_______(从下列选出)。
A.沿玻璃棒缓慢倒入 B. —次迅速倒入 C.分三次少量倒入
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会_____(填“偏大”、“偏小”、“无影响”)。
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是__________________。
A.测量完盐酸的温度再次测最NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净。
B.做本实验的当天室温较高 C.大小烧杯口不平齐,小烧杯口未接触硬纸板。
D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1,反应的平衡常数K1为_________
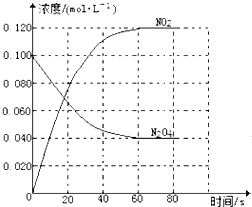
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____________________。
②列式计算温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆,制成豆腐。
B. 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞。
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用。
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料。
(1)甲烷分子的空间构型为 ,可燃冰(mCH4·nH2O)属于 晶体。
(2)已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应
CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH= kJ/mol
(3)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是 。
(4)用甲烷空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:

①a电极名称为 。
②c电极的电极反应式为 。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是 L(空气中O2体积分数约为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应 2SO3(g)![]() 2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:
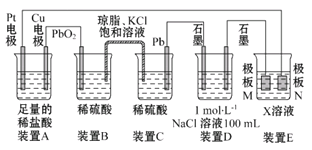
(1)装置B中PbO2上发生的电极反应为____________________________。
(2)装置A中总反应的离子方程式为______________________________。
(3)若装置E的目的是在铜上镀银,则X为____,极板N的材料为____。
(4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com