
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①NH4Cl含有离子键和极性键,属于离子键化合物;
②H2O中只含极性键,属于共价化合物;
③CaCl2中只含离子键,属于离子化合物;
④Si中只含非极性键,属于单质;
⑤Na2O2中含有离子键和非极性键,属于离子键化合物;
⑥H2O2中含有H-O极性键和O-O非极性键,属于共价化合物;
只含有离子键的是③,只含有极性共价键的是②,只含有非极性共价键的是⑥,含离子键和极性共价键的是①,属于离子化合物的是①③⑤,属于共价化合物的是②⑥.
故答案为:③;②;⑥;①;①③⑤;②⑥.
点评 本题考查化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中化学键,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
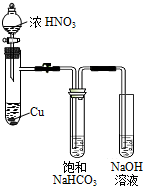 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
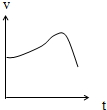 氯酸钾和亚硫酸氢钠发生氧化还原反应生成-1价的氯和+6价的硫 的速率如图所示,已知这个反应的速率除了与反应物浓度有关外,还随着溶液中c(H+)增大而加快
氯酸钾和亚硫酸氢钠发生氧化还原反应生成-1价的氯和+6价的硫 的速率如图所示,已知这个反应的速率除了与反应物浓度有关外,还随着溶液中c(H+)增大而加快查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、Al3+、H+ | B. | Na+ | ||
| C. | Na+、Fe3+ | D. | Na+、Fe2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①表示化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | ②表示其他条件不变时,反应4A(g)+3B(g)?2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
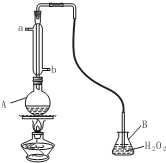 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com