
 ②白磷 ③2,3-二甲基丁烷 ④
②白磷 ③2,3-二甲基丁烷 ④

分析 同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
具有相同分子式而结构不同的化合物互为同分异构体;
同种元素形成的不同单质互为同素异形体;
质子数相同质量数(或中子数)不同的原子互称同位素;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同.
解答 解:⑧ 与①
与① 或与④
或与④ 的结构相似,在分子组成上相差一个CH2,故互为同系物;
的结构相似,在分子组成上相差一个CH2,故互为同系物;
① 与④
与④ 分子式相同,结构不同,属于同分异构体;
分子式相同,结构不同,属于同分异构体;
②白磷与⑥红磷是磷元素组成的不同单质,属同素异形体;
⑤${\;}_{17}^{35}$Cl与 ⑦${\;}_{17}^{37}$Cl 的质子数相同,中子数不同的原子,属于同位素;
⑧ 的系统命名法即为2,2-二甲基丁烷,故与③2,2-二甲基丁烷是同一种物质.
的系统命名法即为2,2-二甲基丁烷,故与③2,2-二甲基丁烷是同一种物质.
故答案为:①⑧或④⑧;①④;②⑥;⑤⑦;③⑧.
点评 本题考查“五同”比较,难度不大,侧重考查学生的辨别能力,选项多,要细心排查.


科目:高中化学 来源: 题型:多选题
| A. | CuCl2(无水CuSO4) | B. | NaOH(H2O) | C. | NaCl(HCl气体) | D. | CuSO4(Cu(OH)2固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl | B. | C2H4Cl2 | C. | C2H6 | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
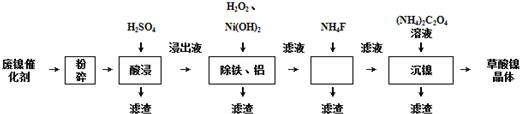
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、Cl-、CO32- | B. | Na+、Mg2+、SO42-、OH- | ||
| C. | K+、Na+、Cl-、OH- | D. | Ba2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于20 mL | B. | 等于30 mL | C. | 大于30 mL | D. | 小于20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
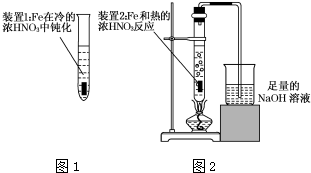 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com