

| A. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型不相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理不相同 |
分析 由结构可知分子式,分子中含-COOH、碳碳双键、-OH及醚键,结合羧酸、烯烃及醇的性质来解答.
解答 解:A.分子中含有2个羧基,则1mol分枝酸最多可与2molNaOH发生中和反应,故A错误;
B.含-COOH、碳碳双键、-OH及醚键,四种官能团,故B错误;
C.含-OH可与乙酸发生酯化反应,含-COOH可与乙醇发生酯化反应,反应类型相同,故C错误;
D.含碳碳双键可使溴的四氧化碳溶液,酸性高锰酸钾溶液褪色,分别发生加成、氧化反应,原理不同,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物性质的应用,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 是一种有机烯醚,可以用烃A通过下列路线获得A$→_{①}^{Br_{2}/CCl}$B$→_{②}^{NaOH水溶液/△}$C$→_{③}^{浓H_{2}SO_{4}/△}$
是一种有机烯醚,可以用烃A通过下列路线获得A$→_{①}^{Br_{2}/CCl}$B$→_{②}^{NaOH水溶液/△}$C$→_{③}^{浓H_{2}SO_{4}/△}$
 的同分异构体的结构简式(写出2种)HC≡CCH2CH2OH、CH3C≡CCH2OH
的同分异构体的结构简式(写出2种)HC≡CCH2CH2OH、CH3C≡CCH2OH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中均含共价键 | |
| B. | 由不同元素组成的多原子分子里,只存在极性键 | |
| C. | HF与HBr相比,分子内共价键更强,所以HF沸点更高 | |
| D. | 硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某粒子的结构示意图如图.试回答:
已知某粒子的结构示意图如图.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向一定量的AgNO3溶液中加入氨水至沉淀消失 | |
| B. | 向一定量的AlCl3中滴加NaOH直到沉淀消失 | |
| C. | 向一定量的CuSO4溶液中加入氨水至沉淀消失 | |
| D. | 向FeCl3溶液中加入KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应 | |
| B. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 | |
| C. | 邻二氯苯不存在同分异构体说明了苯不存在单双键交替的结构 | |
| D. | 1mol甲烷和1mol氯气在光照条件下发生反应,产物只有CH3Cl和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
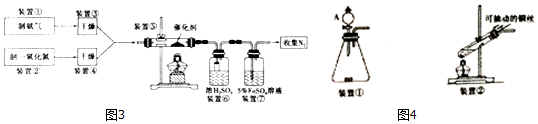
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com