
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+O2(g)=CO2(g)+2H2O (l)△H=-736 kJ•mol-1 |
分析 A.1gC完全燃烧放热为33kJ•g-1,△H=-396 kJ•mol-1,对应生成稳定氧化物为二氧化碳;
B.1g氢气完全燃烧放热为143kJ•g-1,△H=-143kJ•g-1×2g/mol=-283kJ•mol-1;
C.甲烷的燃烧热为△H=-56kJ•g-1×16g/mol=-896 kJ•mol-1,对应生成液态水;
D.甲醇的燃烧热为△H=-23kJ•g-1×46g/mol=-736 kJ•mol-1,对应生成二氧化碳和液态水.
解答 解:A.1gC完全燃烧放热为33kJ•g-1,△H=-396 kJ•mol-1,对应生成稳定氧化物为二氧化碳,则C(s)+O2(g)=CO2(g)△H=-396 kJ•mol-1,故A错误;
B.1g氢气完全燃烧放热为143kJ•g-1,△H=-143kJ•g-1×2g/mol=-283kJ•mol-1,则H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-286 kJ•mol-1,故B错误;
C.甲烷的燃烧热为△H=-56kJ•g-1×16g/mol=-896 kJ•mol-1,对应生成液态水,则CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896 kJ•mol-1,故C错误;
D.甲醇的燃烧热为△H=-23kJ•g-1×46g/mol=-736 kJ•mol-1,则CH3OH(l)+O2(g)=CO2(g)+2H2O (l)△H=-736 kJ•mol-1,故D正确;
故选D.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、焓变的计算、燃烧热为解答的关键,侧重分析与应用能力的考查,注意单位质量与物质的量的区别,题目难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体密度保持不变 | B. | 3v正(N2)=v逆(H2) | ||
| C. | 各物质浓度相等 | D. | c(NH3):c(N2):c(H2)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol-NH2中含有的电子数为0.7NA | |
| B. | 标准状况下,2.24L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65gZn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24LNO与1.12LO2充分反应所得气体中原子数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A在一定条件下有如图所示的转化关系.
,A在一定条件下有如图所示的转化关系.
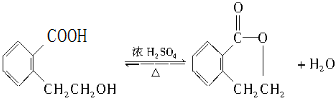 ,写出所有符合下列要求的E的同分异构体的结构简式:
,写出所有符合下列要求的E的同分异构体的结构简式: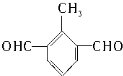 、
、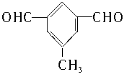 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②⑤ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度高的物体内能不一定大,但分子平均动能一定大 | |
| B. | 当分子力表现为引力时,分子势能随分子间距离的减小而增大 | |
| C. | 外界对物体做功,物体内能一定增加 | |
| D. | 当分子间的距离增大时,分子力一定减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com