
(12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
(1)①强 0.01 mol·L-1HA的pH为2,说明HA完全电离
②<
③c(M+)>c(A-)>c(OH-)>c(H+)
(2)①B ②增大
【解析】
试题分析:(1)①因为浓度0.01mol/L,pH=2,故该酸为一元强酸;②V=50ml滴定终点时,pH<7,为强酸弱碱盐,水解为酸性。故该碱为弱碱,M++H2O MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2) ①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明;
MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2) ①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明;
②CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使c(H+)减小,溶液的pH应增大。
考点:考查弱电解质的电离平衡、盐类水解。


科目:高中化学 来源:2014-2015河南省高二上学期第三次考试化学试卷(解析版) 题型:填空题
(12分)某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为 。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品,放入烧杯内
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是 。
②上述配制过程中,除使用烧杯、量筒外,必不可少的玻璃仪器还有
Ⅱ.标定FeSO4溶液的浓度
(1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.1000 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,据此可测得FeSO4溶液的物质的量浓度为______。
(2)滴定时选用____ (A.石蕊B.酚酞C.不用指示剂,填序号)为指示剂,选用的理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
下列说法正确的是
①可用Ba(OH)2溶液同时鉴别AgNO3、AlCl3、NH4Cl、NaCl、Na2SO4五种溶液
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③因为氧化性:HClO>H2SO4,所以非金属性:Cl>S
④胶体的本质特征是丁达尔现象
⑤除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
A.①②⑤ B.①②④ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
反应:X(g)+3Y(g)  2Z(g) △H<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2Z(g) △H<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率变小,平衡正向移动
B.正反应速率变小,逆反应速率加大,平衡逆向移动
C.正反应速率和逆反应速率都变小,平衡正向移动
D.正反应速率和逆反应速率都变小,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:选择题
已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。

下列说法中错误的是
A.a点表示的溶液中[CH3COO-]略小于10-3 mol·L-1
B.b点表示的溶液中[CH3COO-]>[Na+]
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中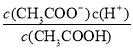 均等于K
均等于K
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:选择题
室温时将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若pH>7,则一定是c1V1=c2V2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c1<c2
D.若V1=V2、c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古巴彦淖尔市高一上学期期中考试化学试卷(解析版) 题型:选择题
已知:①5Cl2+I2+6H2O===2HIO3+10HCl
②ClO3-+5Cl-+6H+===3Cl2↑+3H2O
下列按物质氧化性顺序由强到弱排列正确的是
A.Cl2>ClO3->IO3- B.ClO3->Cl2>IO3-
C.ClO3->IO3->Cl2 D.Cl2>ClO3->IO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高二上学期期中化学试卷(解析版) 题型:选择题
对于达到平衡状态的可逆反应:N2+3H2 2NH3 (正反应为放热反应)下列叙述中正确的是
2NH3 (正反应为放热反应)下列叙述中正确的是
A.反应物和生成物的浓度相等
B.反应物和生成物的浓度不再发生变化
C.降低温度,平衡混合物里氨气的浓度减小
D.增大压强,不利于氨的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com