
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
分析 c(Cr3+)=1×10-5时,可根据KSP[Cr(OH)3]=6.4×10-31计算c(OH-),结合Kw计算c(H+),进而计算pH,以此解答该题.
解答 解:c(Cr3+)=1×10-5时,由KSP[Cr(OH)3]=6.4×10-31可知c(OH-)=$\root{3}{\frac{6.4×1{0}^{-31}}{1×1{0}^{-5}}}$mol/L=1.86×10-9mol/L,则c(H+)=$\frac{1{0}^{-14}}{1.86×1{0}^{-9}}$=5.4××10-6mol/L,pH=5.6,
故选B.
点评 本题考查难溶电解质的溶解平衡的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握计算公式的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | RCl2 | B. | R3O4 | C. | R(OH)3 | D. | HRO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.0g | B. | 4.8g | C. | 3.2g | D. | 5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中一定含有Cl- | |
| B. | 某溶液先加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中一定含有SO42- | |
| C. | 某无色溶液滴入酚酞显红色,该溶液中一定含有大量的H+ | |
| D. | 某溶液中滴加稀硫酸生成无色气体,说明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加适量水 | B. | 通HCl气体 | C. | 加NaOH固体 | D. | 加MgSO4 固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,Ksp(AgCl)=1.8×10-10,Ksp (Ag2CrO4)=1.9×10-12,故Ag2CrO4更难溶 | |
| B. | 在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 在AgCl饱和溶液中,加入AgCl固体,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
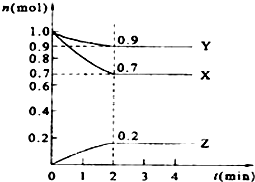 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com