
【题目】某实验小组模拟光合作用,采用电解CO2和H2O的方法制备CH3CH2OH和O2装置如图所示。下列说法不正确的是
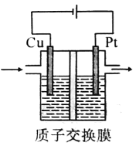
A. 铂极为阳极,发生氧化反应
B. 电解过程中,H+由交换膜左侧向右侧迁移
C. 阴极的电极反应式为2CO2+12H++12e-====CH3CH2OH+3H2O
D. 电路上转移2mol电子时铂极产生11.2LO2(标准状况)
科目:高中化学 来源: 题型:
【题目】苦杏仁酸在医药工业可用于合成头孢羟唑、羟苄唑、匹莫林等的中间体,下列路线是合成苦杏仁酸及其衍生物的一种方法:
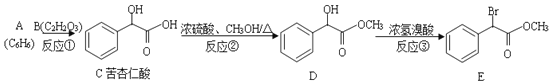
(1)苦杏仁酸中含有的官能团名称__________。
(2)生成C的反应类型_________。B的结构简式____________。
(3)1molE最多可以与___________NaOH反应。
(4)反应③的化学方程式为_______。
(5) 两个C分子可以反应生成具有三个六元环的化合物F,则F的结构简式为______。
(6)写出满足下列条件的C的同分异构体,既能发生银镜反应,又能发生水解反应,遇到FeCl3溶液显紫色,其中苯环上只有两个位于对位取代基,其结构简式为________。
(7)已知:RCH2COOH![]() RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(
RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(![]() )的合成路线______。
)的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
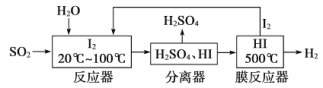
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常用垃圾处理方法有三种:
①________法,可以产生大量肥料;
②________法,可以避免露天堆放产生的问题;
③_____法,可以使垃圾体积缩小,能彻底消灭病原体以及产生热量等优点。
(2)回收利用垃圾资源是现代生活不可忽视的重要活动。请举出生活垃圾回收利用的一个事例:_________。
(3)回收利用垃圾,首先要对垃圾进行分类,一群环保志愿者在某社区推广垃圾分类,他们在垃圾房放置了一些有分类标志的垃圾回收箱,结果却发现有许多居民并没有分类放置。造成这种现象的原因可能是________。
A.居民嫌麻烦,没有垃圾分类的习惯 B.居民每天产生的垃圾量非常多
C.居民的环保意识不强 D.居民不清楚垃圾分类的标准
(4)
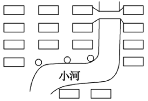
上图是某居民小区中垃圾收集点(小圆圈)的布局,它在选址上存在的两个问题是_________和________。垃圾收集点选址应考虑的因素包括(提出三点)________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2和O2, Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3 混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O![]() Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置 A 中反应的离子方程式是______。
(3)装置 E中反应的化学方程式是_____。
(4)装置 B 中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置 C 的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
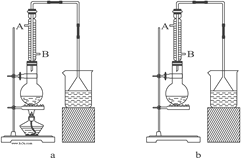
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30℃时,利用下图装置进行实验,结果记录如下表所示:

实验 | a电极 | b电极 | 电解质溶液 | 现象 |
I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
II | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
III | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
下列说法不正确的是( )
A. II中Al为负极,其电极反应是:Al - 3e- = Al3+
B. III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行
C. IV中Fe为负极,发生了氧化反应
D. 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com