
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 →CH≡CH的化学方程式(注明条件)
→CH≡CH的化学方程式(注明条件) +2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O.
+2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O. 和
和 合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).
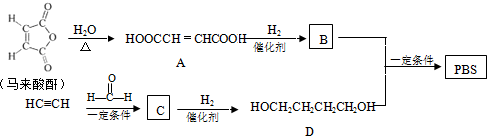
合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).分析 马来酸酐和水发生加成反应生成A,A和氢气发生加成反应生成B,B为HOOCCH2CH2COOH;
乙炔和甲醛反应生成C,C和氢气发生加成反应生成D,根据D结构简式结合题给信息知,C为HOCH2C≡CCH2OH,B和D反应生成PBS,PBS结构简式为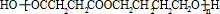 ,
,
(6)由CH3CH2CH2Br合成CH3CH2 CH2CH2OH,可将CH3CH2CH2Br通过消去、加成、消去生成CH3C≡CH,再用CH3C≡CH与HCHO发生题中信息的反应,最后再催化加氢得产品.
解答 解:马来酸酐和水发生加成反应生成A,A和氢气发生加成反应生成B,B为HOOCCH2CH2COOH;
乙炔和甲醛反应生成C,C和氢气发生加成反应生成D,根据D结构简式结合题给信息知,C为HOCH2C≡CCH2OH,B和D反应生成PBS,PBS结构简式为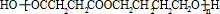 ,
,
(1)A中含氧官能团是羧基,故答案为:羧基;
(2)通过以上分析知,C为HOCH2C≡CCH2OH,故答案为:HOCH2C≡CCH2OH;
(3)通过以上分析知,B+D→PBS的反应类型为缩聚反应,故答案为:缩聚反应;
(4)马来酸酐的同分异构体符合下列条件:
a.能发生银镜反应,说明含有醛基;
b.能与NaHCO3反应产生CO2,说明含有羧基;
c.分子中所有碳原子在同一条直线上,
符合条件的同分异构体结构简式为HOOCC≡CCHO,
故答案为:HOOCC≡CCHO;
(5) 和NaOH的醇溶液加热生成CH≡CH,反应方程式为
和NaOH的醇溶液加热生成CH≡CH,反应方程式为 +2NaOH$→_{△}^{乙醇}$CH≡CH
+2NaOH$→_{△}^{乙醇}$CH≡CH
+2NaBr+2H2O,
故答案为: +2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH+2NaBr+2H2O;
(6)由CH3CH2CH2Br合成CH3CH2 CH2CH2OH,可将CH3CH2CH2Br通过消去、加成、消去生成CH3C≡CH,再用CH3C≡CH与HCHO发生题中信息的反应,最后再催化加氢得产品,具体合成线路为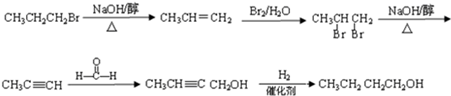 ,
,
故答案为: .
.
点评 本题考查有机物推断和有机合成,为高频考点,明确物质官能团及其性质关系是解本题关键,难点是有机合成路线的设计,可以根据反应物采用正向思维进行设计也可以根据生成物采用逆向思维进行设计,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
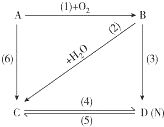 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | He | B. | S | C. | Si | D. | P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100 nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴,溴元素又称“海洋元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
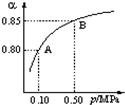 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.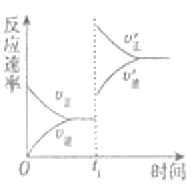
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com