
【题目】下列物质互为同分异构体的一组是( )
A.乙醇和乙酸
B.CH3CH2OH和CH3OCH3
C.12C与13C
D.金刚石和石墨
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:

(1)①元素和②元素可以形成最简单的有机物,其化学式为____;
(2)③元素原子的最外层电子数为____;
(3)①元素与④元素形成的化合物的电子式为____(写出一种即可);
(4)②、③、④三种元素的非金属性逐渐____(填“减弱”或“增强”);
(5)④元素和⑥元素形成的氢化物,其稳定性的强弱顺序为_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类是工业上重要的有机原料,具有广泛用途。乙酸苯甲酯![]() 对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
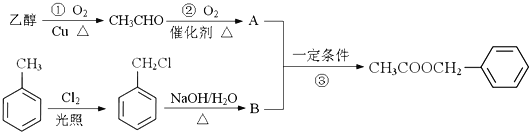
已知:R-Cl![]() R-OH,R-为烃基
R-OH,R-为烃基
(1)乙酸苯甲酯的分子式是________,B所含官能团的名称是________。
(2)写出反应③的化学反应方程式:________。反应①的反应类型是__________,反应③的反应类型是________________。
(3)下列转化中________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
A.乙醇制取乙醛 B.由![]() 制备
制备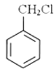 C.2CH3CHO+O2
C.2CH3CHO+O2![]() 2A
2A
(4)提纯乙酸苯甲酯的有关实验步骤如下:将反应液冷至室温后倒入分液漏斗中,分别用饱和碳酸钠溶液和水洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏,收集馏分,得到乙酸苯甲酯。
回答下列问题:
①在洗涤、分液操作中。应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸苯甲酯从分液漏斗上口倒出
b.直按将乙酸苯甲酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸苯甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸苯甲酯从上口放出
②实验中加入少量无水MgSO4的目的是__________________。
③在蒸馏操作中,仪器选择及安装都正确的是____________(填标号)。
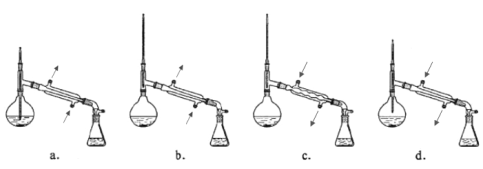
(注:箭头方向表示水流方向)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是中学化学重要的非金属元素之一,请回答下列有关问题。
已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ/mol
2NO2(g) △H=-113.0kJ/mol
(1)反应NO2(g)+ SO2(g)![]() SO3(g)+NO(g)的ΔH= ______kJ/mol 。
SO3(g)+NO(g)的ΔH= ______kJ/mol 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 _________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时消耗1 molNO
(3)S2Cl2和SCl2均为重要的工业化合物。已知:
a.S2(l)+Cl2(g)![]() S2Cl2(g) △H1
S2Cl2(g) △H1
b.S2Cl2(g)+ Cl2(g)![]() 2SCl2(g) △H2
2SCl2(g) △H2
—定压强下,向10 L密闭容器中充入1 molS2Cl2和1 mol Cl2,发生反应b。Cl2与SCl2的消耗速率(υ)与温度(T)的关系如图所示:
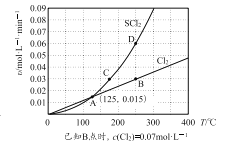
① A、B、C、D四点对应状态下,达到平衡状态的有______(填字母),理由是_______。
②—定温度下,在恒容密闭容器中发生反应a和反应b,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________(填“增大”或“减小”或“不变”),理由是________。
II.氮有不同价态的化合物,如氨、氮气、亚硝酸钠、乙二胺等。
图(I)和图(II)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。
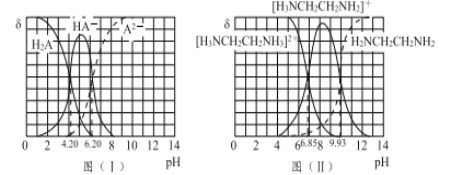
(1)H3NCH2CH2NH3A溶液显____(填“酸”或“碱”)性。
(2)乙二胺在水溶液中发生第二步电离的方程式:____________________,其平衡常数Kb2= _______________________ 。
(3)向20 mL 0.1 mol/L的H2A溶液加入10 mL 0.1 mol/L H2NCH2CH2NH2溶液后,溶液中各离子浓度大小的关系为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在0.5L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
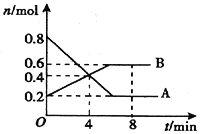
(1)该反应的化学方程式为__________。
(2)0~4min内,用B表示的反应速率v(B)=__________。
(3)第4min时,正、逆反应速率的大小关系为:v(正)__________v(逆),(填“>”“<”或“=”)。
(4)下列措施能加快反应速率的是__________。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③它的同分异构体中有芳香族化合物
④1mol该有机物水解时只能消耗1molNaOH
⑤1mol该有机物在一定条件下能和3mol H2反应.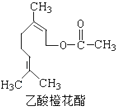
A.①②③
B.①②④
C.①②⑤
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的a~g元素,回答下列问题:
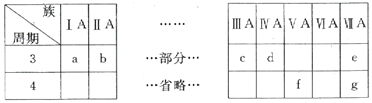
(1)d元素位于金属与非金属的分界线处,常用作__________材料。
(2)f的元素符号为As,其最高价氧化物的化学式为__________。
(3)a、b、c三种元素的最高价氧化物对应水化物的碱性逐渐减弱,试从原子结构的角度解释上述变化规律__________。
(4)e元素的非金属性强于g,请写出一个离子方程式证明:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案中制取一氯乙烷的最佳方法是( )
A. 乙烷和氯气取代反应 B. 乙烯和氯气加成反应
C. 乙烯和HCl加成反应 D. 乙炔和HCl加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com