
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
分析 分子式为C8H9Cl,不饱和度为4,又为芳香族化合物,苯环本身的不饱和度就为4,这说明与会考虑取代基时不用考虑不饱和键;
取代基可以是1个:-CH2CH2Cl;-CHClCH3;
取代基可以是2个:-CH2Cl、-CH3;-CH2CH3、-Cl;
取代基可以是3个:-Cl、-CH3、-CH3;
然后根据位置异构确定同分异构体.
解答 解:分子式为C8H9Cl芳香族化合物中含有苯环、饱和烃基、氯原子;
当取代基可以是1个:-CH2CH2Cl;-CHClCH3,有2种同分异构体;
取代基可以是2个:-CH2Cl、-CH3;-CH2CH3、-Cl,根据邻、间、对位置异构可知,共有3+3=6种同分异构体;
取代基可以是3个:-Cl、-CH3、-CH3;
2个甲基处于邻位时,-Cl有2种位置,有2种同分异构体;
2个甲基处于间位时,-Cl有3种位置,有3种同分异构体;
2个甲基处于对位时,-Cl有1种位置,有1种同分异构体;
所以符合条件的同分异构体共有14种;
故选D.
点评 本题主要考查了同分异构体的书写,苯环上的取代基种类和数目决定了同分异构体的种类,注意取代基的分类.


科目:高中化学 来源: 题型:选择题
| A. | 自然界中含有大量游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | Si、P、S、Cl相应的氧化物对应水化物的酸性依次增强 | |
| C. | 工业上通常用电解熔融氧化铝制得金属铝 | |
| D. | 金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
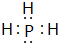 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
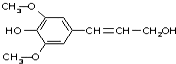 膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇能发生的反应类型有氧化、取代、水解、加聚 | |
| B. | 芥子醇的分子式是C11H14O4,属于芳香烃 | |
| C. | 芥子醇分子中所有碳原子可能在同一平面 | |
| D. | 芥子醇能与3mol溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | |
| C. | c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+ | |
| D. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
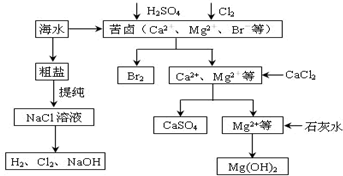

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol•L-1的KClO3溶液中,K+的个数为NA | |
| B. | 在标准状况下,22.4 L CH3CH2OH的分子数为NA | |
| C. | 32 g氧气和臭氧的混和气体中含有的氧原子数为2NA | |
| D. | 22.4 L HCl气体中含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com