
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
(2)在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识____是氧化剂,_____是还原剂,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
【答案】8.5g 80.25g K2Cr2O7 HCl 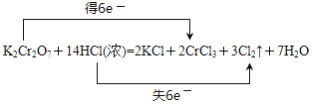
【解析】
根据氧化还原反应的本质、氧化还原反应中双线桥的表示方法分析解答。
(1) 反应8NH3+3Cl2==6NH4Cl+N2,N元素从-3价升高到0价,即NH3是还原剂,被氧化,Cl元素从0价降低到-1价,即Cl2是氧化剂,被还原,生成还原产物NH4Cl,从方程式中可知,8分子NH3中只有2分子NH3中的N元素被氧化,所以34gNH3中只有![]() =8.5g被氧化,34gNH3的物质的量为:
=8.5g被氧化,34gNH3的物质的量为:![]() ,依据方程式可推断出,还原产物n(NH4Cl)=1.5mol,即m(NH4Cl)= 1.5mol×53.5g/mol=80.25g;
,依据方程式可推断出,还原产物n(NH4Cl)=1.5mol,即m(NH4Cl)= 1.5mol×53.5g/mol=80.25g;
故答案为:8.5g ;80.25g;
(2)反应 K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,K2Cr2O7的Cr元素化合价+6价降低到+3价,即K2Cr2O7在反应中是氧化剂,得到6个电子,HCl中的Cl元素化合价从-1价升高到0价,即HCl在反应中是还原剂,失去6个电子,用双线桥表示为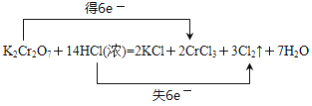 ,故答案为:K2Cr2O7 ;HCl;
,故答案为:K2Cr2O7 ;HCl; 。
。


科目:高中化学 来源: 题型:
【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
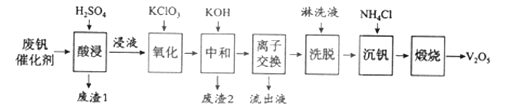
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下,反应 X(g)+3Y(g![]() 2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是
2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是

A. 图中a、b两点对应的平衡常数相等
B. 上述反应在达到平衡后,缩小体积,Y的转化率提高
C. 升高温度,正、逆反应速率增大,平衡向正反应方向移动
D. 将2.0molX、6.0molY,置于密闭容器中发生反应,放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某铜银合金的组成,将30.0g合金溶于80.0mL 13.5mol·L1的浓HNO3中。待合金完全溶解后,收集到气体6.72L(标准状况下)并测得H+浓度为1mol·L1。假设反应后溶液的体积为80.0mL,试计算:
(1)被还原的硝酸的物质的量___________;
(2)合金中银的质量分数___________。
(3)确定6.72L气体中各成分的物质的量___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.5mol·L-1的CH3COOH溶液中逐滴滴加0.5mol·L-1的NaOH溶液,滴定曲线如图。相关分析正确的是
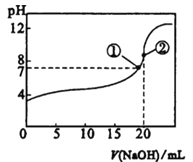
A. 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应
B. 滴加至②时,c(OH-)—c(H+) =c(CH3COOH)
C. 滴定中,c(CH3COO-)/c(H+)逐渐减小
D. 滴定中,c(CH3COOH)与c(CH3COO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
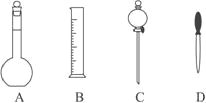
【题目】(1)实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是_________。
具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(2)上述过程的正确顺序为___________(填步骤序号);
(3)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体; B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水; D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤; F、定容时俯视刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于3Br2+6NaOH![]() 5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
A. Br 2既是氧化剂,又是还原剂
B. 被氧化的溴原子与被还原的溴原子质量比是1:5
C. NaBr是氧化产物,NaBrO3是还原产物
D. 转移1mol电子时,消耗NaOH 1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com