
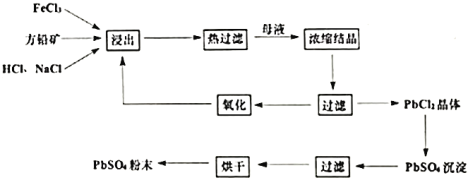
【题目】硫酸铅是一种重要的化工粉末材料,被广泛用于涂料和电池等行业。湿化学法从方铅矿(主要成分为![]() )直接制取硫酸铅粉末的转化流程图如下:
)直接制取硫酸铅粉末的转化流程图如下:
已知:①![]()
②![]()
![]()
回答下列问题:
(1)浸出过程中,产物中![]() 以
以![]() 形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为________。
(3)氧化过程中通常加入![]() ,发生反应的离子方程式为__________。
,发生反应的离子方程式为__________。
(4)向![]() 固体中加入
固体中加入![]() ,发生反应的方程式为
,发生反应的方程式为![]()
![]() ,计算该反应的平衡常数为________。
,计算该反应的平衡常数为________。
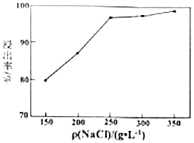
(5)单位体积溶液中加入![]() 的质量对方铅矿的浸出率的影响如图,高于
的质量对方铅矿的浸出率的影响如图,高于![]() 之后,浸出率基本不变,可能的原因是_____________。
之后,浸出率基本不变,可能的原因是_____________。
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是________(任写两点)。
【答案】![]()
![]()
![]() 是吸热反应,降温有助于平衡逆向移动,便于获得更多的
是吸热反应,降温有助于平衡逆向移动,便于获得更多的![]() 固体
固体 ![]()
![]() 浸出后的溶液已经是
浸出后的溶液已经是![]() 的饱和溶液,再增加氯化钠,浸取率基本不变 流程简单;能耗低;不产生
的饱和溶液,再增加氯化钠,浸取率基本不变 流程简单;能耗低;不产生![]() ,对环境无污染
,对环境无污染
【解析】
往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于![]() △H>0正向移动,使PbCl2溶解,过滤除去硫等杂质,母液中含有
△H>0正向移动,使PbCl2溶解,过滤除去硫等杂质,母液中含有![]() 、Cl-、Fe2+、Fe3+等,母液蒸发浓缩,析出PbCl2晶体,过滤后的滤液中含有Fe2+、Fe3+,氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,据此分析解答。
、Cl-、Fe2+、Fe3+等,母液蒸发浓缩,析出PbCl2晶体,过滤后的滤液中含有Fe2+、Fe3+,氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,据此分析解答。
(1)浸出过程中,产物中![]() 以
以![]() 形式存在,同时可观察到黄色沉淀,该黄色沉淀为硫,浸出过程中的反应的离子方程式为
形式存在,同时可观察到黄色沉淀,该黄色沉淀为硫,浸出过程中的反应的离子方程式为![]() 。反应后期,有少量气体产生,是PbS在氯化钠溶液中与盐酸反应放出的硫化氢气体,产生气体的化学方程式为
。反应后期,有少量气体产生,是PbS在氯化钠溶液中与盐酸反应放出的硫化氢气体,产生气体的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2) ![]() 是吸热反应,降温有助于平衡逆向移动,因此浓缩结晶过程中需要将浸出液静置于冰水混合物中,便于获得更多的
是吸热反应,降温有助于平衡逆向移动,因此浓缩结晶过程中需要将浸出液静置于冰水混合物中,便于获得更多的![]() 固体,故答案为:
固体,故答案为:![]() 是吸热反应,降温有助于平衡逆向移动,便于获得更多的
是吸热反应,降温有助于平衡逆向移动,便于获得更多的![]() 固体;
固体;
(3)氧化过程中通常加入![]() ,过氧化氢能够将亚铁离子氧化生成铁离子,反应的离子方程式为
,过氧化氢能够将亚铁离子氧化生成铁离子,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;/p>
;/p>
(4)向![]() 固体中加入
固体中加入![]() ,发生反应的方程式为
,发生反应的方程式为![]()
![]() ,该反应的平衡常数K=
,该反应的平衡常数K=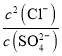 =
=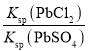 =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(5)根据单位体积溶液中加入![]() 的质量对方铅矿的浸出率的图象,高于
的质量对方铅矿的浸出率的图象,高于![]() 之后,浸出后的溶液已经是
之后,浸出后的溶液已经是![]() 的饱和溶液,再增加氯化钠,浸取率基本保持不变,故答案为:浸出后的溶液已经是
的饱和溶液,再增加氯化钠,浸取率基本保持不变,故答案为:浸出后的溶液已经是![]() 的饱和溶液,再增加氯化钠,浸取率基本不变;
的饱和溶液,再增加氯化钠,浸取率基本不变;
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的流程简单、能耗低、不产生![]() ,对环境无污染,故答案为:流程简单;能耗低;不产生
,对环境无污染,故答案为:流程简单;能耗低;不产生![]() ,对环境无污染。
,对环境无污染。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得2个电子、B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数。C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个。
(1)A的元素名称是_______,B的元素符号是______。
(2)D原子的原子结构示意图为____________,B+的离子结构示意图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.20 mol NO和0.20 mol CO混合气体充入容积为2.0 L的恒容密闭容器中,分别在T1和T2温度下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
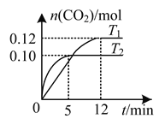
A.T1<T2
B.容器内气体的密度不再改变时反应到达平衡
C.T2温度下,该反应的平衡常数K=10
D.T1温度时,前12 min的平均反应速率v(CO)=0.01 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是探究温度对化学反应速率的影响的实验,其中三支试管中均为3 mL滴有FeCl3溶液的5% H2O2溶液(如下图所示)。
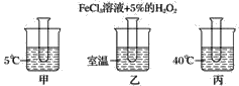
(1)三支试管内溶液产生氧气气泡速率由大到小为________。
(2)由上述实验可得出的结论为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量变化的实验方案和实验步骤如图所示,根据下面的实验方案和步骤回答下列问题:
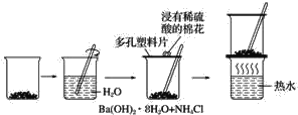
下表是某学生根据上述实验方案和步骤列表整理的实验事实和结论:
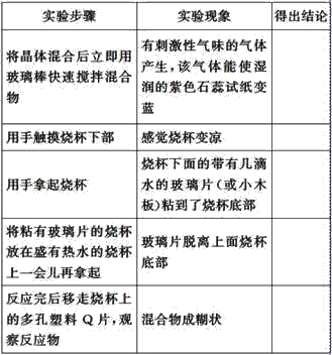
(1)请你根据实验现象得出相应的实验结论填入上表中。_________________。
(2)用化学方程式表示上述反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒厂用含丰富淀粉的农产品做原料经过发酵酿酒,回答下列问题:
(1)写出主要反应的化学方程式:
第一步________________________________;
第二步________________________。
(2)某酒厂生产的啤酒长时间放置产生沉淀,造成产品滞销,经化验可知沉淀物为蛋白质。为解决这一问题,提出了两种方案。
甲:在酒中加入少量蛋白酶;
乙:在酒中加入少量氨基酸氧化酶。
试评价这两种方案:
①________方案合理,原因是_______________________;
②________方案不合理,原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com