
| A. | 运用水玻璃堵塞管道,是因为水玻璃显碱性 | |
| B. | 配制碘水时,常加入少量的KI,目的是防止I2被还原 | |
| C. | 用酸化的高锰酸钾与H2O2可制取少量氧气,KMnO4作催化剂 | |
| D. | 明矾[KAl(SO4)2•12H2O]净水和液氯(Cl2)净水的原理不相同 |
分析 A.水玻璃为硅酸钠的水溶液,具有粘性;
B.由于碘在水中的溶解度很小,通常在配制I2溶液时加入过量的KI以增加其溶解度,降低I2的挥发性;
C.高锰酸钾与双氧水发生氧化还原反应,高锰酸钾做氧化剂;
D.明矾水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,氯气与水反应生成次氯酸,具有强的氧化性,能够杀菌消毒.
解答 解:A.运用水玻璃堵塞管道,是因为硅酸钠水溶液具有粘性,故A错误;
B.由于碘在水中的溶解度很小,通常在配制I2溶液时加入过量的KI以增加其溶解度,降低I2的挥发性,故B错误;
C.用酸化的高锰酸钾与H2O2可制取少量氧气,KMnO4作氧化剂,故C错误;
D.明矾溶于水后Al3+水解生成Al(OH)3胶体,Al(OH)3胶体具有吸附性,能吸附水中的悬浮杂质而净水;Cl2溶于水后生成HClO,HClO具有强氧化性,能杀菌消毒而净水,故D正确;
故选:D.
点评 本题考查了物质的用途,性质决定用途,明确硅酸钠、高锰酸钾、碘、明矾的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O与Na2O2颜色相同 | B. | 均可与CO2、H2O反应产生氧气 | ||
| C. | 所含氧元素的化合价均为-2 | D. | 阴阳离子的个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A. | 该物质既可看作醇类,也可看作酚类 | |
| B. | 1mol该物质可与4molBr2反应 | |
| C. | 1mol该物质可与7molNaOH反应 | |
| D. | 1mol该物质可与7molNa反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
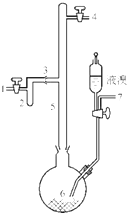 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=8的溶液:K+、Fe3+、NO3-、Cl- | |
| B. | 能与Al反应产生H2的溶液:K+、Na+、SO42-、Cl- | |
| C. | 含FeCl3的溶液:K+、NH4+、I-、SCN- | |
| D. | c(OH-)=1×10-13 mol•L-1的溶液:NH4+、Na+、Si32-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z形成的化合物中不可能既有离子键 | |
| B. | X和Z、M和Y、Z和W均可形成原子个数比为1:1的化合物 | |
| C. | Y、Z、W、M形成的简单离子半径大小关系为Y>Z>M>W | |
| D. | W与Cl形成化合物的熔点低于M与Cl形成化合物的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中滴入盐酸:OH-+H+=H2O | |
| B. | Cl2与冷NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 盐酸与AgNO3反应:Ag++HCl=AgCl↓+H+ | |
| D. | 氢氧化钡溶液与稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com