
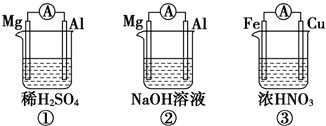
| A. | ①②中Mg作负极,③中Fe作负极 | |
| B. | ②中Al作正极,其电极反应式为Al-3e-=Al3+ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | 若①②中转移的电子数相同,则①②中产生的H2的量也一定相同 |
分析 A.①中更活泼的金属镁失电子作负极,②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应,则铝作负极,③中铁在浓硝酸中会钝化,铜作负极;
B.②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝作负极失电子被氧化产生AlO2-;
C.③中铁在浓硝酸中会钝化,铜作负极发生氧化反应;
D.①②中产生的都是氢气,转移电子数相同,产生的氢气的量相同.
解答 解:A.①中更活泼的金属镁失电子作负极,②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应,则铝作负极,③中铁在浓硝酸中会钝化,铜作负极,故A错误;
B.②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝作负极失电子被氧化,电极反应为:2Al+8OH--6e-=2AlO2-+4H2O,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B错误;
C.③中铁在浓硝酸中会钝化,铜作负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu-2e-═Cu2+,故C错误;
D.①②中产生的都是氢气,H2~2e-,转移电子数相同,产生的氢气的量相同,故D正确;
故选D.
点评 本题考查学生原电池的工作原理知识,电极的活泼性与电解质溶液有关,如镁和铝在氢氧化钠溶液中铝活泼,而铁与铜在冷的浓硫酸和浓硝酸中铜活泼,难度中等.


科目:高中化学 来源: 题型:解答题
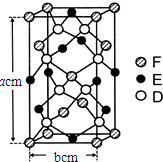 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
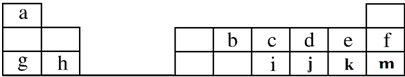
 ,元素d与元素g形成的原子个数比为1:1的化合物的电子式为
,元素d与元素g形成的原子个数比为1:1的化合物的电子式为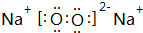 ;(用元素符号填空)
;(用元素符号填空)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
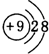
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
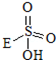 →
→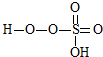 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO均难溶于水 | |
| B. | CO、NO均为酸性氧化物 | |
| C. | CO、NO均为无色无味的有毒气体 | |
| D. | 在催化剂的作用下,可通过反应2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2来达到净化汽车尾气的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质熔沸点的高低顺序是:晶体硅>氯化钠>干冰>汞 | |
| B. | 分子晶体中一定存在分子间作用力 | |
| C. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | CO2、HCl、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>H2SiO3 | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:HF>HCl>HBr | D. | 原子半径:Cl>S>O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L 0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cu2+个数小于0.5NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移电子数为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com