
| 56×85.7% |
| 12 |
| 56-12×4 |
| 1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液++氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(aq) |
| △ |
| CO2 |
| O2/点燃 |
| H2O |
| 足量CO2 |
| △ |
| HCl(aq) |
| △ |
| △ |
| 熟石灰 |
| H2O,CO2 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
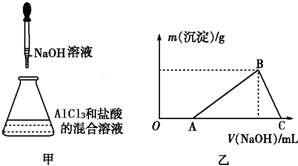
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
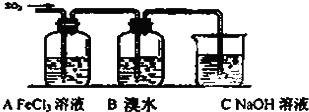
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | SO2与Fe3+反应生成了Fe2+ | |
| 方案③ | 往第二份试液中加入 | SO2与Fe3+反应生成了SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 试剂及方法 |
| 检验自来水中是否含有Cl- | |
| 除去Na2CO3固体中少量的NaHCO3 | |
| 鉴别丝绸和棉布 | |
| 证明某地雨水样品呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中采用高压条件 |
| B、由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C、用排饱和食盐水的方法收集Cl2 |
| D、反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com